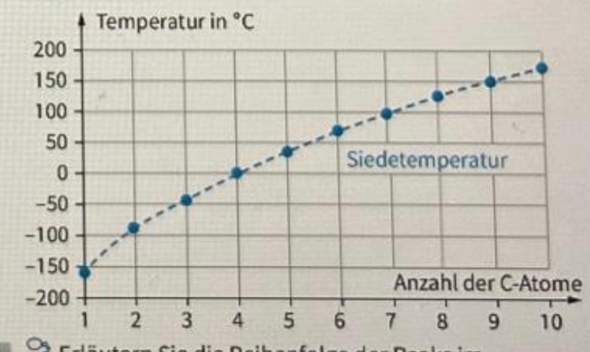
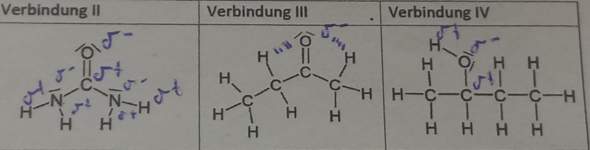
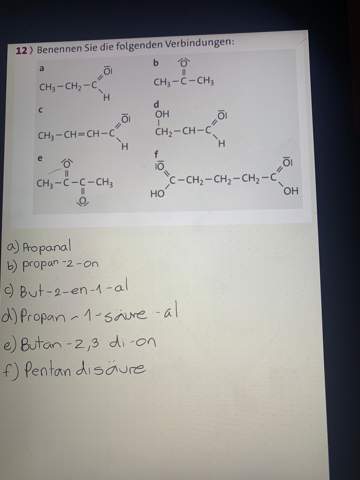
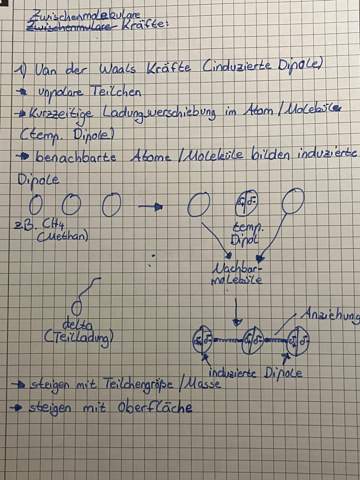
Warum hat Calciumoxid im Vergleich zu Bariumoxid eine kleinere Schmelztemp.?
Wenn man sich das Coloumb Gesetz anschaut dann haben die Atome die einen höheren Radius haben auch eine höhere elektrostatische Kraft im Ionengitter.
In dem Fall hat Barium einen höheren Atomradius als Calcium, müsste dann nicht Bariumoxid die höhere Schmelztemperatur haben?