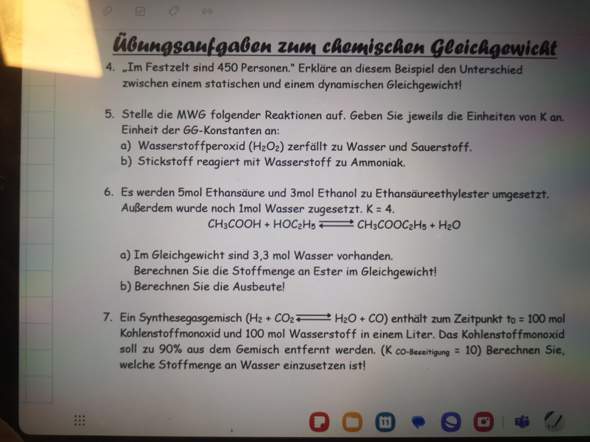
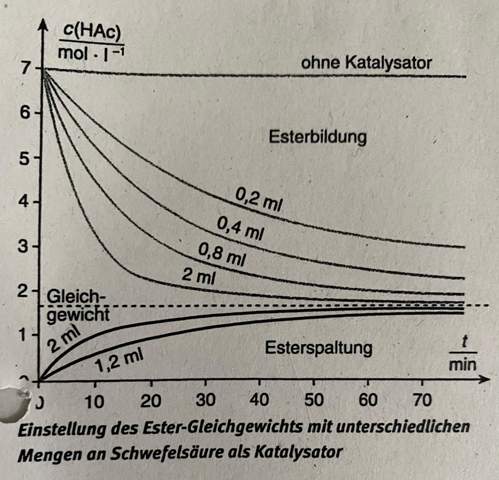
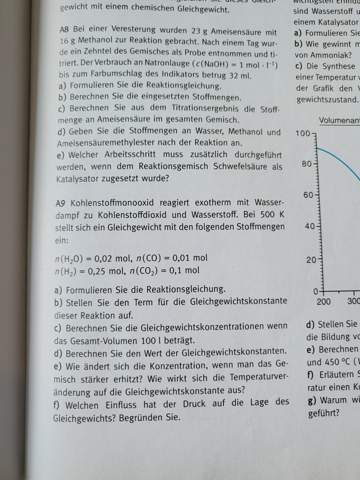
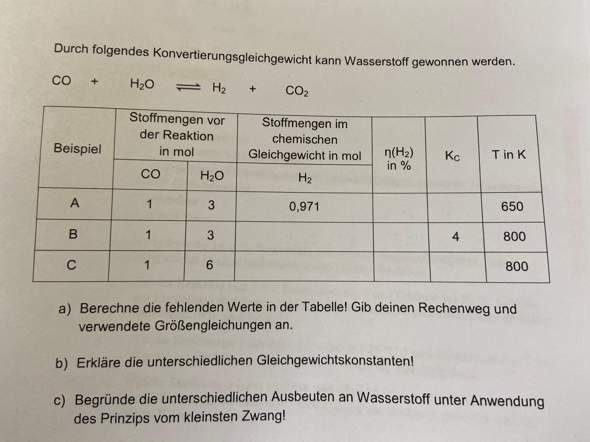
Konzentrationen im chemischen Gleichgewicht anhand von Ausgangskonzentrationen berechnen?
Hey ihr 😊,
ich sitze jetzt schon sehr lange an folgender Aufgabe dran:
Die Lösung soll sein: c (BrCl)= 0,0769 mol/l
c (Br2) = c (Cl2) 0,0291 mol/l
Ich habe jetzt schon sehr viele Ansätze ausprobiert, aber ich komme nicht auf diese Zahlen. Meine Überlegungen wären:
- Da K einen Wert über 1 hat, muss die Produktkonzentration im Gleichgewicht zunehmen, dh. es müsste sich etwas zu den anfänglichen 0,045 mol/l dazu addieren. Das würde auch zu der Lösung von BrCl passen.
- Die Edukt Konzentration muss dann also abnehmen, dh. weniger sein als die 0,045 mol/l am Anfang. Auch das passt mit der Lösung überein.
Logisch wäre es für mich so:
Das hat aber nicht funktioniert. Aus anderen Kommentaren hab ich herausgelesen, dass man die Produktkonzentration noch zusätzlich mal 2 nehmen muss, da ja pro Reaktion 2 Produktmoleküle entstehen. Allerdings dachte ich immer man hat diese Information schon durch die hoch 2 bei den Produkten mit einbezogen. Die Hochzahlen stehen ja genau für diese Koeffizienten in der Reaktionsgleichung. Deswegen verstehe ich nicht warum man es jetzt nochmal zusätzlich mal zwei nehmen soll.
Jedenfalls wäre mein Ansatz, wenn man dieses mal 2 noch mit einbeziehen muss, folgender:
Allerdings komme ich auch hier auf das falsche Ergebnis, oder ich löse einfach falsch die Gleichung auf. Ich habe auch schon versucht das mal 2 an anderen Stellen hinzusetzen, vor die Klammer, oder die 0,045 mol/l aus der Klammer weg gelassen, aber auch damit klappt es leider nicht.
Ich bin langsam echt am verzweifeln, deswegen wäre ich für eine Erklärung sehr Dankbar😊