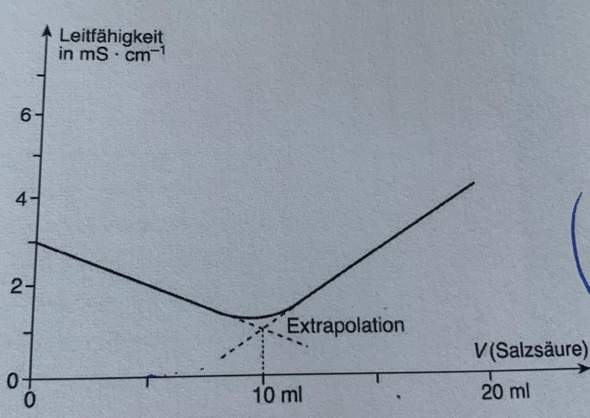
Die Analysenlösung befindet in einem 100mL Messkolben. 25mL Analysenlösung werden mit 30mL Ethanol versetzt. Nach Zusatz von 20mL Wasser und 0,1mL Phenolrotlösung wird mit Natriumhydroxidlösung (0,1 mol/L) bis zum Farbumschlag titriert.
Titer der Maßlösung = 0,9875
Dann sind noch 3 Werte aus dem Titrationsprotokoll angegeben.
Bestimmung 1: 17,55mL; Bestimmung 2: 18,05mL; Bestimmung 3: 17,80mL
Also wenn ich das in die Formel einsetze, wenn das die richtige ist.
m (Salycilsäure) = c(Natriumhydr.) * t (ML) * Z* * M(Salycils.) * V (ML) /Z*
Also für Volumen der Maßlösung würde ich den Mittelwert aus den 3 Bestimmungen einsetzen.
Und wenn ich die Masse rausbekomme, muss ich das fa berechnen, d.h. 100mL/4 weil es 4 Aliquote sind.
Aber müsste ich nicht m = m (Durchschnitt) * fa, bzw. das Ergebnis nur mal fa also den 4 Aliquoten weil ich ja den Durchschnittswert schon am Anfang berechne.