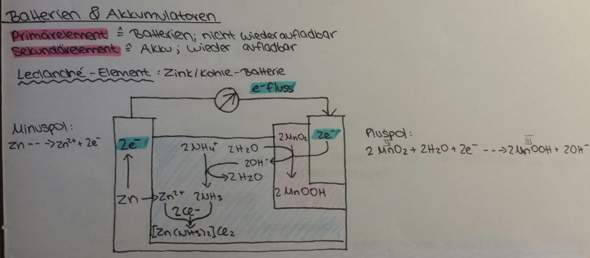
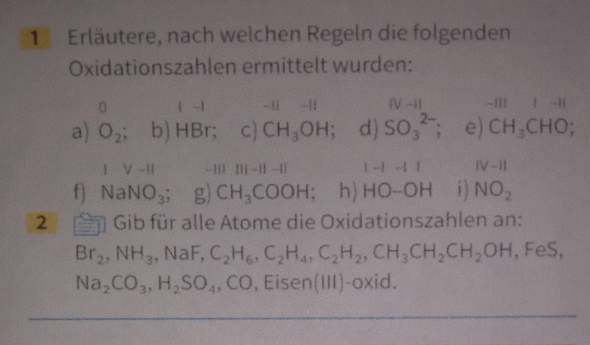
Redoxreaktionen aufstellen (Aufgabe)?
Hallo,
Ich habe folgende Aufgaben bekommen:
1.In saurer Lösung reagieren Permangant-Ionen mit Nitrit (NO2-) zu Mangan(II)-Ionen und Nitrat-Ionen.
2.In alkalischer Lösung reagieren Permanganat-Ionen mit Wasserstoffperoxid (H2O2) zu Sauerstoff und Braunstein.
3.Permanganat-Ionen reagieren in neutraler Lösung mit Sulfit-Ionen (SO3^2-) zu Braunstein (MnO2) und Sulfat-Ionen.
Ich habe bis jetzt:
1. MnO4 + NO2- -> Mn + 2NO3-
2. MnO4 + H2O2 -> 3O2 + MnO2 (keine Ahnung, wo das H hinkommt)
3. MnO4 + SO3^2- -> MnO2 + SO4^2- (hier weiß ich nicht wie ich ausgleichen soll)
Kann mir wer helfen und sagen, ob das was ich bis jetzt habe richtig ist?