Oxidationszahl und Redoxreaktion?
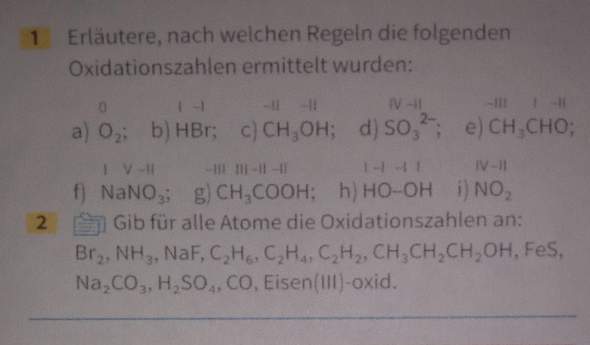
Bin eigentlich ganz gut in Chemie, aber hier komm ich nicht mehr mit. Falls mir jemand die Aufgaben lösen kann wäre das sehr nett. Bin 10. Klasse und wir haben eigentlich gerade Thema Alkane, Alkohole, Aldehyde, etc. Bitte helft mir!
Danke im Voraus
ps. weiß jmd was eine concept map ist?

Das Blatt das wir zur Aufgabe bekommen haben
2 Antworten
Ich möchte hier einen Weg darstellen.
Bei ionenverbindungen vergleicht man die Zahl der Valenzelektronen (VE) vor und nach der Bindung: so ist im NaF das Na mit +1 und F mit -1 anzusetzen, denn Na hat 1 Elektron abgegeben, das das F aufgenommen hat.
Bei kovalenten Bindungen erhält (virtuell) der elektronegativere Partner das ganze E.paar; danach wird wieder mit dem isolierten Atom und seinen VE verglichen. So ergibt sich bei allen Elementen sofort immer null; bei Bindungen zwischen gleichartigen Atomen z. B zwischen C-C kriegt jedes Atom 1 Elektron der Bindung
Beispiel 1g
CH3COOH
Linkes C nimmt 3 Paare von den 3 H (denn H ist das el.positivste) teilt sich 1 Paar mit dem anderen C (gleiche EN), hat also 7 für sich; eingebracht hat es 4--> Ox.zahl also -3
Rechtes C: teilt sich mit dem linken C 1 Paar, gibt an OH und O insgesamt 3 Paare, behält nur 1 e: also OZ +3.
Die H haben (wie zumeist) +1, die O (wie zumeist) -2.
Die Summe der OZ ergibt die Gesamtladung des Moleküls bzw. der Formeleinheit in diesem Beispiel 0.
Was für Regeln habt ihr schon durchgenommen / stehen in eurem Buch dazu? Als Denkanstösse: Elemene haben..., In neutralen Molekülen..., Bei geladenen Molekülen..., Gruppe X hat meistens die Oxidationszahl ..., Eine Auflistung von typischen Ox-zahlen (im PSE)... Damit kann man 98 % der Schulbeispiele beantworten.
hallo, habe das blatt das wir zur aufgabe bekommen haben ergänzt. wäre nett wenn du mir jetzt noch helfen könntest