Chemie Redoxreaktionen wässrige Lösung?
Kann jemand diese Aufgabe zu Redoxreaktionen lösen? Verstehe sie nicht.
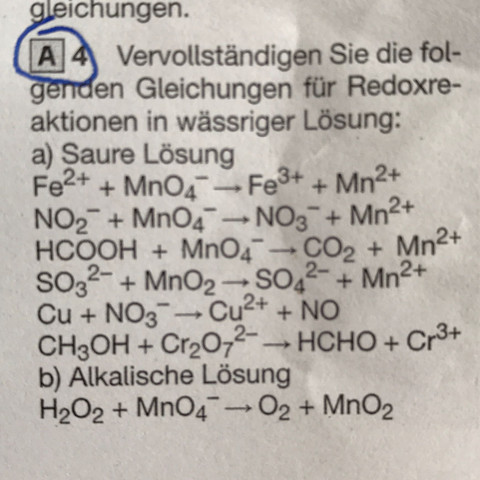
1 Antwort

In den Aufgaben sind von den Reaktionsgleichungen jeweils nur die Moleküle/Molekülionen angegeben, die / von denen ein Atom reduziert oder oxidiert werden, und auch die stöchiometrischen Vorfaktoren sind ausgelassen worden. Die Aufgabe besteht darin, die Faktoren und die übrigen Reaktionspartner auf beiden Seiten so zu ergänzen, dass die Gleichung "stimmt". Hierbei ist insbesondere auf die Ladung zu achten und darauf, wie im sauren bzw. alkalischen Milieu die Ladung von "außen" ausgeglichen werden kann, falls erforderlich.
Ich rechne mal die erste Teilaufgabe durch:
-----
1. Teilaufgabe:
? Fe^(2+) + ? MnO_4^(-) + ? --> ? Fe^(3+) + ? Mn^(2+) + ?
Die Fragezeichen stehen für die gesuchten Zahlen und Formeleinheiten.
Tiefstellungen werden durch _, Hochstellungen durch ^ gekennzeichnet, um möglichst ohne Sonderzeichen auszukommen.
-----
Schauen wir uns erst mal die Teilgleichung für das Eisen an (um die Elektronen ergänzt):
Fe: Fe^(2+) + ? e^(-) --> Fe^(3+) + ? e^(-)
Hier bleibt offensichtlich als einzige Möglichkeit:
Fe: Fe^(2+) --> Fe^(3+) + 1 e^(-)
Da am Eisen keien weiteren Atome hängen, sind wir hier mit der Redox-Teilgleichung fertig.
-----
Teilgleichung für Mangan
(wir lassen zunächst die übrigen Atome weg - die nehmen nicht an Redoxgleichungen teil. Eigentlich müsste man das noch begründen, aber bei Sauerstoff ist es selten, dass er eine andere Oxidationszahl als -2 hat.)
Mn: Mn^(7+) + ? e^(-) --> Mn^(2+) + ? e^(-)
Mn: Mn^(7+) + 5 e^(-) --> Mn^(2+)
Hier sind wir noch nicht fertig - die Sauerstoffatome fehlen noch
Mn^(VII)O_4^(-II) + 5 e^(-) --> Mn^(2+) + 4 O^(2-) (formal)
hier bleiben formal 4 Sauerstoff-Ionen übrig, die sind alles andere als stabil.
Da wir uns in saurer Lösung befinden, stehen genug H_3O^(+)-Ionen zur Verfügung, um daraus Wasser zu bilden.
(Im alkalischen Milieu müssten sich die Sauerstoffionen Wasserstoffionen aus Wassermolekülen "klauen".)
Das nächstliegende stabile Ion wäre das OH^(-), aber das wird im Sauren sofort neutralisiert. Also bilden die Sauerstoffionen direkt Wasser:
O^(2-) + 2 H_3O^(+) --> H_2O + 3 H_2O
bzw.
O^(2-) + 2 H_3O^(+) --> 3 H_2O
Für die 4 O^(2-) in obiger Formel brauchen wir natürlich 4mal so viele H_3O^(+), und es enstehen 4mal so viele H_2O:
Mn^(VII)O_4^(-II) + 5 e^(-) + 8 H_3O^(+) --> Mn^(2+) + 12 H_2O
-----
Jetzt müssen wir noch die beiden Teilgleichungen irgendwie zusammenkriegen.
In der Mangan-Teilgleichung werden auf der linken Seite 5 e^(-) verbraucht, auf der rechten Seite der Eisenreaktion wird nur 1 e^(-) frei.
Also müssen wir die Mn-Gleichung mit 1 und die Fe-Gleichung mit 5 erweitern ("überkreuz"), damit die Elektronenbilanz stimmt:
MnO_4 + 5 e^(-) + 8 H_3O^(+) --> Mn^(2+) + 12 H_2O
5 Fe^(2+) --> 5 Fe^(3+) + 5 e^(-)
Summe dieser beiden Gleichungen:
5 Fe^(2+) + MnO_4^(-) + 5 e^(-) + 8 H_3O^(+) --> Mn^(2+) + 12 H_2O + 5 Fe^(3+) + 5 e^(-)
Die Elektronen heben sich genau auf, was ja auch das Ziel der "Erweiterung" war. Es bleibt:
5 Fe^(2+) + MnO_4^(-) + 8 H_3O^(+) --> Mn^(2+) + 12 H_2O + 5 Fe^(3+)
oder - schöner sortiert (Redox-Partner nach links, Lösungsmittel und seine Ionen nach rechts):
5 Fe^(2+) + MnO_4^(-) + 8 H_3O^(+) --> 5 Fe^(3+) + Mn^(2+) + 12 H_2O
was die fertige Lösung des 1. Teils ist.
-----
P. S.: Ich habe die Rechnungen nicht kontrolliert; wenn irgendwelche Zahlenwerte falsch sind, bitte nicht wundern
Oke die anderen bitte auch noch!