Redoxreaktion Chemie?
ich habe folgende Produkte und Edukte gegeben. Beim Wasserstoffperoxid beträgt die Oxidationszahl für den Wasserstoff +1 und für den Sauerstofff -1. Bei der Oxidation werden dann zwei Elektronen auf der Produkt Seite hinzugefügt. Aber eigentlich gleichen sich die Oxidationszahlen von H und O doch aus und es ist 0. Dann würde zwar keine Oxidation zu O2 stattfinden, aber so würde es von den Oxidationszahlen für mich Sinn ergeben. Kann mir jemand erklären wieso man die Oxidationszahl vom Wasserstoff nicht beachtet? Und woher weiß ich, dass O hier -1 und nicht wie üblich -2 hat?
1 Antwort
Hi,
Beim Wasserstoffperoxid beträgt die Oxidationszahl für den Wasserstoff +1 und für den Sauerstofff -1.
Korrekt.
Bei der Oxidation werden dann zwei Elektronen auf der Produkt Seite hinzugefügt.
Auch korrekt.
Aber eigentlich gleichen sich die Oxidationszahlen von H und O doch aus und es ist 0.
Das macht auch Sinn, da die Summe der Oxidationszahlen immer der Molekülladung entsprechen muss. Bei H2O2 ist die Molekülladung Null. Ladungstechnisch mit OH(-) oder H(+) ausgeglichen wird die Gesamtladung aller auf einer Seite befindlichen Teilchen. Das ist rechts -2 (wegen den 2e-) und links erstmal Null, weshalb 2 OH(-) hinzugefügt werden müssen. Auf beiden Seiten muss die Gesamtladung hier -2 betragen.
Kann mir jemand erklären wieso man die Oxidationszahl vom Wasserstoff nicht beachtet?
Weil das Sauerstoffatom oxidiert wird, mit dem Wasserstoffatom aber nicht viel passiert. Das, was reduziert wird, ist ja das Kaliumpermanganat (bzw. dort konkret das Mangan-Ion) in der anderen Teilgleichung.
Und woher weiß ich, dass O hier -1 und nicht wie üblich -2 hat?
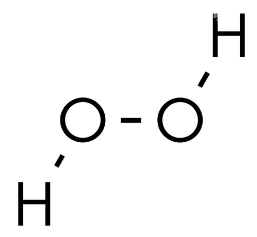
Das liegt daran, dass H2O2 wie folgt aussieht:
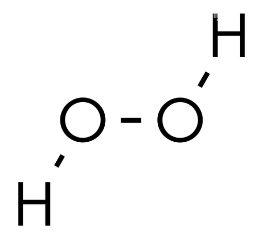
Es gibt also eine O-O-Bindung im Molekül, wodurch die Oxidationszahl bei Sauerstoff nur noch -1 ist. Wasserstoff hat immer (außer bei Metallhydriden) die Oxidationszahl +1.
Wenn du noch Fragen hast, dan melde dich.
LG