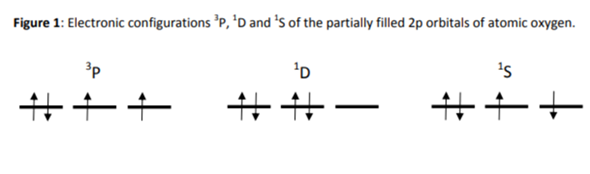Wie kommt man auf das Termschemata für diese p-Zustände?
Atomarer Sauerstoff hat folgende Zustände in den 2p Orbits, wobei der linke der Grundzustand ist.
Die anderen beiden sind angeregte Zustände.
Nun verstehe ich nicht, wie man auf die Termbezeichnugen im Bild kommt:
bedeutet ja soweit ich weiß (?), dass die gesamte Drehimpulsquantenzahl L=1="P" ist und die 3 bedeutet die gesamte Spin-Multiplizität, d.h. in diesem Fall ist der Gesamtspin S=1
hat Drehimpulsquantenzahl L=2="D" und die 1 bedeutet die Spin-Multiplizität, d.h. in diesem Fall ist der Gesamtspin S=0
hat Drehimpulsquantenzahl L=0="S" und die 1 bedeutet die Spin-Multiplizität, d.h. in diesem Fall ist der Gesamtspin S=0
Frage: Wie kommt man nun darauf, dass Der Drehimpuls L im ersten Fall 1, im zweiten 2 und im dritten 0 ist?
Ich sehe hier kein System das ich anwenden könnte.