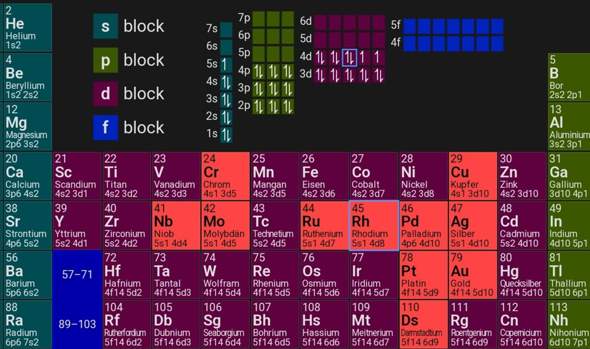
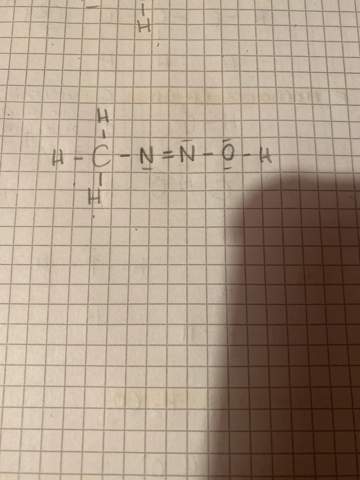Unregelmäßigkeiten bei der Elektronenkonfiguration von ÜM?
In der IV. Nebengruppe und der IX. Nebengruppe wird bei z.B. Chrom oder Kupfer ein Elektron aus dem s-Orbital in das energetisch höhergelegene d-Orbital angehoben, um ein (halb-)volles d-Orbital zu schaffen.
Doch warum passiert das bei Wolfram nicht. Und warum wird bei Rhodium ein Elektron aus dem s-Orbital hinzugefügt, um nur 3 Orbitale vollständig zu besetzen?