Molekülorbitalmodell, Kohlenstoff?
Hallo an alle,
Weshalb ist Kohlenstoffdioxid im Orbitalmodell linear? Ich weiß, dass die Elektronenpaare den größtmöglichsten Abstand zueinander suchen. Aber warum genau ist das so?
Zudem habe ich mich mit dem VSEPR-Modell auseinandergesetzt, aber die Winkelvergrößerung bzw. Verkleinerung, da freie Elektronenpaare mehr Raum als bindende Elektronen beanspruchen, ist mir auch nicht schlüssig.
Wäre sehr dankbar, könnte mir das jemand erklären..
2 Antworten
In der einfachsten Sichtweise besteht zu jedem der O-Atome eine Doppelbindung, deren Ebenen senkrecht zueinander stehen. Ein freies Elektronenpaar am C-Atom gibt es nicht.
Ich weiß nicht, wie ich das ohne Zeichnung oder Medell weiter erklären soll, daraus ergibt sich eine lineare Anordnung.
Kann man glaubich schon, aber bevor ich den Stift schwinge, kannst du ja mal das Netz durchsuchen. Über die Bildersuche findet man oft schneller, was man sucht.
Hier hast du ein Bild
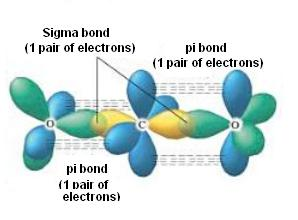
Etwas vereinfacht, aber man sieht ganz gut worums geht.
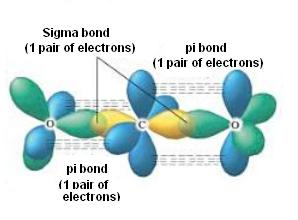
Ich danke ihnen. Dann hatte ich es ja sogar richtig gezeichnet :)
Ich danke ihnen für die Antwort. Und ja, es ist schade, dass man keine Zeichnungen anhängen kann