Wie finde ich die nicht bindenden Elektronenpaare heraus?
Hallo,
ich habe gerade in der Schule das Thema "Aufstellen der Lewis-Formel". Ich verstehe, was bindende und nicht bindende Elektronenpaare sind, aber ich verstehe nicht, wie ich herausbekomme, wie viele Elektronen(paare) nicht bindend und bindend sind.
Zum Beispiel hier in diesem Screenshot aus einem Video:
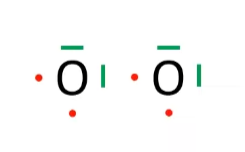
Woher weiß ich jetzt, dass die beiden nicht bindenden Elektronen (die Roten) nicht einfach auch zu einem nicht bindenden Elektronenpaar werden (Also ein grünes)?
1 Antwort
Atome versuchen Mithilfe der Atombindung die Oktettregel zu erfüllen, dh. sie wollen eine volle Außenschale (mit meist 8 Elektronen). Sauerstoff (O) hat 6 Außenelektronen, also fehlen ihm 2, deswegen verbinden sich 2 Sauerstoff Atome zu einem Sauerstoff Molekül und teilen sich dabei 2 Elektronen (1 Elektronenpaar), wodurch sie eine volle Außenschale mit 8 bekommen. Für sie würde es also keinen Sinn machen wenn sie ihre weiteren Elektronen auch noch teilen würden, bzw haben sie gar nicht erst das Verlangen danach, da die Oktettregel bereits erfüllt ist.
Außerdem sind die Grünen keine bindenden Elektronenpaare, sondern gan normale, in deinem Bild. In der Lewisschreibweise schließen sich die roten Punkte nicht nochmal zu einem Elektronenpaar zusammen, da auf jeder Seite was stehen muss.
ich bin sehr aufgeschmissen und sehr am Ende ich brauche wirklich jemand der mir das beibringt über discord oder so
Ich geb mein disc leider nd raus... du kannst mir aber gerne eine freundschaftsanfrage über gutefrage schicken und mir dann fragen stellen
Wir schreiben morgen eine chemie Arbeit hättest du zeit uns das beizubringen?
Hilfreich
0