AsCl 4+ Molekulare Geometrie (VSEPR) ?
Hallo,
wie ermittle ich die molekulare Geometrie von AsCl 4+? Bzw. habe ich es richtig gemacht?
Ich weiß, dass ich zunächst erst die Lewis Struktur ermitteln muss.
As hat 5 Valenzelektronen, Cl hat 7 Valenzelektronen. Davon ziehe ich 1 ab, da es sich um ein positives Ion handelt.
-> 5-1 + (7x4) = 32 Valenzelektronen
Da es sich bei Cl um das negativste Element handelt, wird dieses das Zentralatom bilden. Da die anderen 3 Cl auch die Elektronen anziehen, werden sie dem Zentralatom näher stehen als das As und somit eine tetraedische Form bilden.
Das Zentralatom besitzt 3 Doppelbindungen und 1 Einfachbindung und besitzt selbst kein freies Elektronenpaar ---> AX4. Dies würde die Tetraeder-Form bestätigen.
Stimmt diese Annahme?
Ich bin etwas eingerostet, was Chemie anbelangt... Die freien Elektronen von den "umgebenden" 3 Cl und dem As sind egal, oder? Nur das Zentralatom ist wichtig, oder?
Danke schon mal im Voraus!
Grüße, bracedface
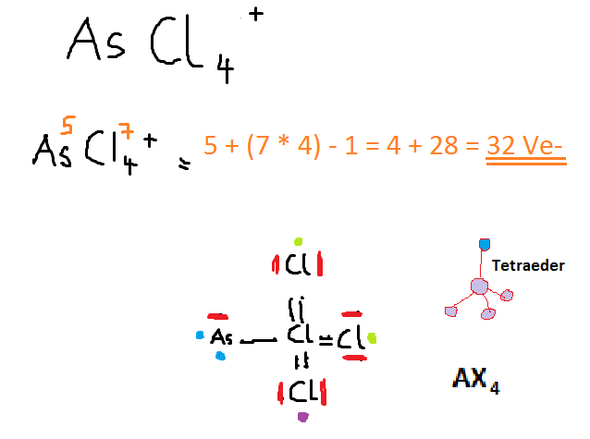
1 Antwort
Nein, also Cl-Cl-Bindungen treten natürlich nicht auf. Das postulierte Molekül ist nicht existent.
Überlege dir zunächst die Struktur von AsCl3. Es hat tatsächlich Tetraeder-Struktur und zwar mit dem As im Zentrum, drei Cl an den Ecken und einem freien Elektronenpaar an der vierten Ecke.
Die Struktur von AsCl4(+) folgt daraus: Statt des freien Elektronenpaars sitzt hier einfach ein Chlor. As im Zentrum, vier Cl an den Ecken des Tetraeders.As hat hier die Oxidationsstufe +V, daher ist auch kein freies Elektronenpaar mehr vorhanden.
Also die Regel, dass das Zentralatom das elektronegativste Atom sein sollte, ist totaler Quatsch. Das solltest du ganz vergessen.
Das mit dem Atom in Unterzahl ist zwar keine Regel oder so, aber wenn ich so über die allermeisten typischen Beispiele nachdenke, ist das durchaus eine sehr gute Vorgehensweise. Das kommt meistens hin.
Du guckst dir halt an, dass da Chlor mit seinen 7 Elektronen eigentlich ja einfach nur gerne eine Einfachbindung machen würde (Klar gibt es auch Ausnahmen, z.B. Interhalogenverbindungen, aber meistens ist das so). Daher kann das Chlor ja gar nicht in die Mitte. Das Gleiche gilt meistens für die anderen Halogene und Wasserstoff ebenso. Atome, die nur einmal im Molekül vorkommen und mehrere Bindungen ausbilden können ==> Die sind ja perfekt für das Zentrum.
Ahh, ok danke. Ich war zunächst im Zweifeln ob das geht, da ich mich daran erinnern konnte das der Lehrer uns soetwas gesagt hat, aber dann war ich unsicher wegen der Elektronegativität. Also, wenn es eine Überzahl gleicher Atome gibt, dann wird das Atom, welches in Unterzahl ist, zum Zentralatom, auch wenn dieses nicht das elektronegativste ist? Ist das so immer der Fall oder gibt es dazu irgendeine Regel?
Dankeschön!