Unregelmäßigkeiten bei der Elektronenkonfiguration von ÜM?
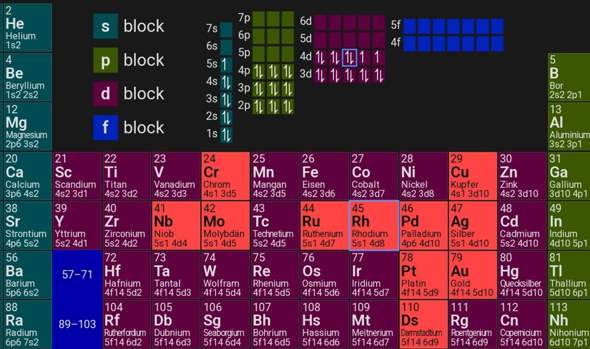
In der IV. Nebengruppe und der IX. Nebengruppe wird bei z.B. Chrom oder Kupfer ein Elektron aus dem s-Orbital in das energetisch höhergelegene d-Orbital angehoben, um ein (halb-)volles d-Orbital zu schaffen.
Doch warum passiert das bei Wolfram nicht. Und warum wird bei Rhodium ein Elektron aus dem s-Orbital hinzugefügt, um nur 3 Orbitale vollständig zu besetzen?
1 Antwort
Wenn ein Elektron lieber in ein 3d- als in ein 4s-Orbital möchte, ist das 3d-Orbital offensichtlich nicht höher gelegen. Beide Typen liegen energetisch nah beieinander, und da entscheiden Kleinigkeiten wie die gegenseitige Abstoßung der Elektronen im selben Orbital. Auch magnetische Kräften spielen eine Rolle, aber da bin ich raus.
Überhaupt kann man zwar mit Floskeln wie "halb- oder vollbesetze Unterschalen" um sich werfen, aber das reicht eher, zu begründen, warum etwas so ist, aber nicht es vorherzusagen, wenn man es nicht weiß. Vielleicht gibt es hier Leute, die das wirklich begründen können, aber da bin auch ich dann wahrscheinlich raus.
Übrigens gibt es nicht das d-Orbital, sondern 5 davon, die zusammen auch als d-Unterschale bezeichnet werden.