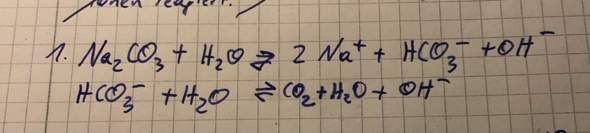Chemie Verseifung?
Hi, kann jemand den Text korrigieren? Es geht um die Verseifung. Es wurde Ethanol, Speiseöl, Natronlauge und Natriumchlorid verwerndet. Natriumchlorid wurde zum Schluss beim 2. Mal Schütteln hinzugegeben und dabei entstanden Flocken beim Reaktionsgemisch…
Das Ethanol ist dabei ein Lösemittel, damit die Hydroxid-Ionen mit dem Fett reagieren können. Das Öl wird durch die OH-Ionen gespalten, bzw. die Estergruppe werden gespalten und dabei entsteht der dreiwertige Alkohol Glycerin. zudem entstehen die jeweiligen Alkalisalze, der ik den Fetten vorkommenden Fettsäuren. Dies wird durch den Schaum bemerkbar. Bei der Zugabe von NaCl-Lösung bildet sich das Fettsäureanion Seife, die als Flocken sichtbar waren. Pro Glycerin Molekül sind 3x Carbonsäure Moleküle gebunden also entstehen 3x Fettsäureanionen..
Stimmt das so? Was kann ich ergänzen? Ändern?