Bin noch in der Prüfungsvorbereitung, kann eigentlich schon alles aber gerade beim durchgehen noch ein Beispiel gefunden was ich grade nicht durchblicke hoffe ihr Könnt mir helfen ^^
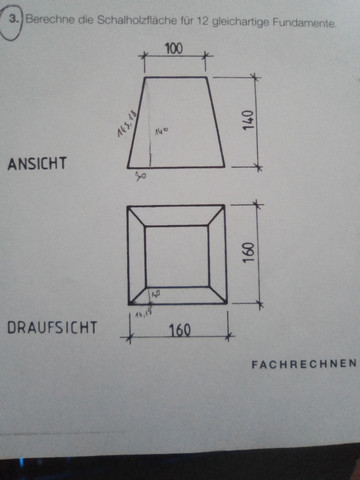
Also es geht um ein Fundament in dem Beispiel:
(Angaben in cm)
Die Grundfläche ist 160*160
Höhe ist 140
Und die obere Fläche ist 100*100
Also auf jeder Seite ist eine Schräge, wie ich die berechne weiß ich auch.
Also zuerst die 160-100=60/2=30 dann hab ich überall die Differenz
Um dann die Schräge zu errechnen mit dem Satz des Pythagoras
Also 30²+30² dann die Wurzel daraus ergibt dann 42.43, also die auf der Grundfläche die Schräge nach innen. Und mit der is dann die Äußere Schräge zu berechnen, nach dem selben Muster.
Also 42.43²+140² und die Wurzel aus dem Ergebnis ergibt bei mir dann 146.29
Soweit so gut, jetzt strauchle ich etwas, Hatte das Beispiel vor Jahren in meiner Schulzeit und die nächsten Rechenschritte verstehe ich nicht.
Da wurde offensichtlich die Ansicht genommen, die Dreiecke rechts und links weggedacht und einfach nur 100*140 gerechnet, aber auch die rechteckigen Flächen sind ja schräg, also müsste man sich da ja wieder die Schräge ausrechnen, bei mir 143.18 und die mit den 100 multiplizieren oder?
Und bei den Dreiecken steig ich dann Komplett aus, damals rechnete ich dann für die Fläche 42.43, also die Schräge auf der Grundfläche von Außen nach innen mal 140, dann hätte ich ja die Fläche von einem Dreieck was IN der Figur sich befindet oder? Also Müsste es komplett Falsch sein.
Hab bisschen überlegt, das einzige was für mich Sinn ergeben würde wäre, wenn ich 30*143.18 rechnen würde, ansonsten bin ich Ratlos.
Hoffe jemand von euch versteht es und kann mir da weiterhelfen wie ich da an die Flächen komme.
Danke schonmal!