Kann mir bitte die nr.2 lösen bitte ich versteh es nicht?

1 Antwort
Von gutefrage auf Grund seines Wissens auf einem Fachgebiet ausgezeichneter Nutzer
Chemie, Base, Formel
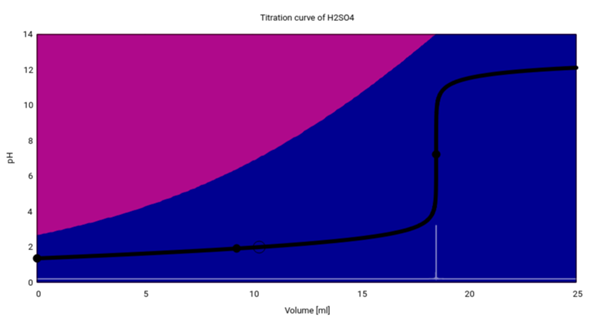
Du verbrauchst 18.5 ml Natronlauge c=0.1 mol/l, das entspricht einer Stoffmenge von n=cV=1.85 mmol NaOH. Die Reaktionsgleichung lautet:
2 NaOH + H₂SO₄ ⟶ Na₂SO₄ + 2 H₂O
also verbracht ein Mol NaOH nur ½ mol H₂SO₄, und daher entsprechen die 1.85 mmol NaOH nur n=0.925 mmol H₂SO₄. Diese waren in V=25 ml Lösung enthalten, also betrug die H₂SO₄-Konzentration c=n/V=0.037 mol/l.
Als Bonus gibt es hier noch die Titrationskurve:

Du siehst, daß am Anfang eine Mischung aus Sulfat SO₄²¯ (blau) und Hydrogensulfat HSO₄¯ (violett) in der Lösung herumschwimmt. Im Lauf der Titration wird das Hydrogensulfat abgebaut, und am Äquivalenzpunkt verschwindet es dann, so daß praktisch aller Schwefel als Sulfat vorliegt.
Woher ich das weiß:Studium / Ausbildung – Chemiestudium mit Diss über Quantenchemie und Thermodynamik