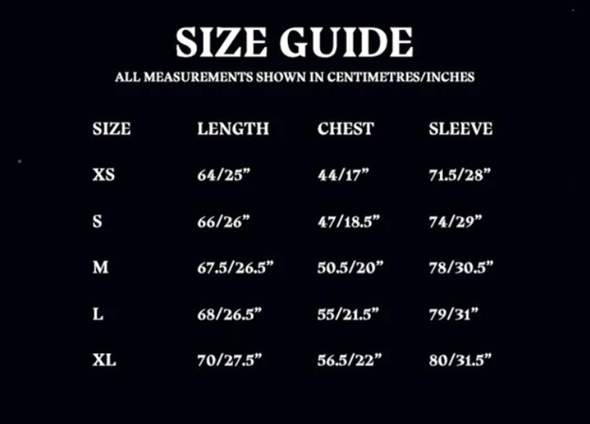
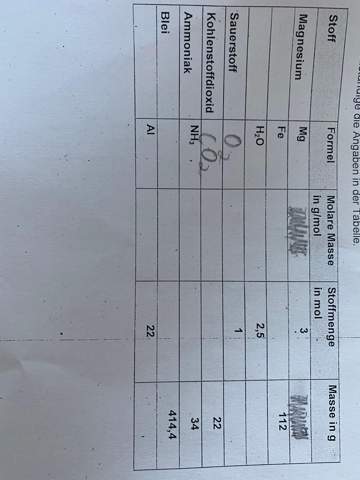
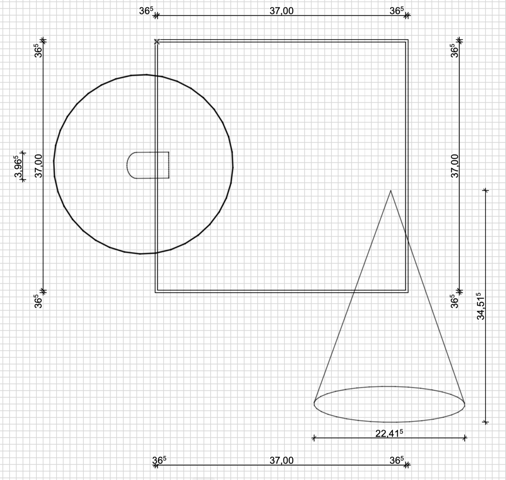
Masse verdichten um Zeit schneller wirken zu können?
Ich habe eine Frage nämlich Masse zieht Zeit an und hat seine eigene und wenn man weiter entfernt von Masse ist ( was nicht geht weil der Körper ja Masse ist ) vergeht dann die Zeit langsamer und wenn man es schaffen würde sehr viel Masse auf einen Punkt zu bringen würde die Zeit dann schneller vergehen