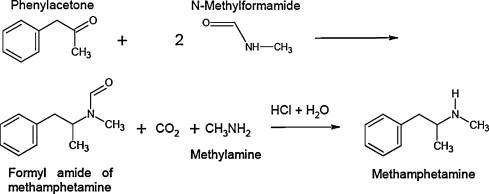
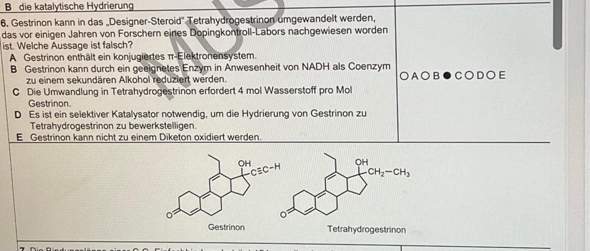
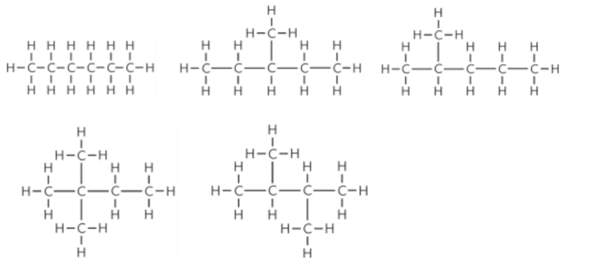
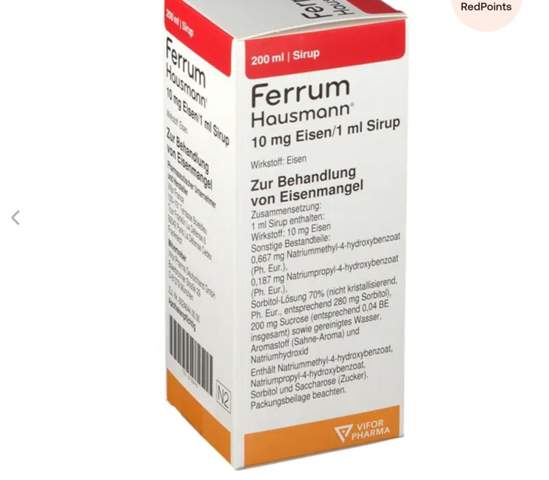
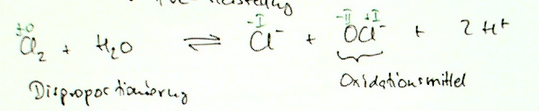Immer wieder stolpere ich bei Aufgaben zur Klausurvorbereitung auf den gefürchteten Satz: "Stellen SIe die Reaktionsgleichung auf":
Wie z.b. hier bei der Aufgabe:
"Was beobachten Sie, wenn sie ein Stückchen Kakl mit halbkonzentrierter Salzsäure übergießen. Stellen SIe die Reaktionsgleichung uaf".
Ich weß, dass Kalk die Summenformel CaCO3 hat.
Salzsäure ist HCL.
Salzsäure git Protonen (H+-Ionen) im Wasser ab.
Da hier das Wort "gießen" vorkommt (und ich meine damit nicht die Stadt in Hessen), muss Wasser im Spiel sein, also H2O.
HCL + H2O ergibt H3O plus + Cl minus..
Das Cl minus reagiert nicht weiter mit CaCo3, also nehmen wir es -wie Mickymaus - aus dem Spiel heraus.
WIr haben jetzt also CaCO3 + HCl.
Da das Cl minus nicht mit CaCo3 reagiert, "splitten" iwr das ganze .
Wir gucken uns einmal Ca und Cl an und dann nochmal CO3 und H.
Zuerst Ca und Cl:
Ca hat das Ionensymbol Ca 2 +
Chlor ist in der 7. Hauptgruppe, hat also -I.
Wir haben also Ca2+ und Cl- . Mit der Kreuzregel ergibt sich CaCl2.
Jetzt gucken wir uns H und CO3 an.
H hat die Ladung H+.
CO3 hat das Ionensymbol CO3 2-
Wir haben also H+ und CO3 2-. Mit der Kreuzregel ergibt sich H2CO3.
H2CO3, da könnnen wir jetzt H2O "abzwacken", dann ergibt sich H2o + CO2.
Wir haben jetzt also CaCl2, H2O und CO2 als Produkte.
Jetzt steht da aber in der Musterlsöung: Ca 2+ + 3H2O + CO2.)
Das find ich bisschen komisch, weil das Ca2+ war ja bereits da, bevor wir die Kreuzregel gemacht haben.. (Nach der Kreuzregel hatten wir Ca Cl2)
Das H2O und CO2 ergab sich ja erst nach der Kreuzregel. (Davor war es H+ + CO3 2-, danach war es H2CO3, woraus wir H2O und CO2 machen konnten).
Wie kommt man überhaupt auf das alles? Das hab ich mir jetzt alles durch Internetrechere zurrecht gereimt.
- Woher weiß ich, dass ich HCl mit Wasser reagieren lassen muss, um es in H3O + und CL minus zu ersetzen
- Woeher weiß ich dass ich in der Reaktionslgeichung nicht HCl hinschreibe, sondern das H3O +
- Warum verwendet man die Kreuzregel bei H+ und CO3 2- an und nicht bei Ca2+ und Cl-?
- Wie kommt man überhaupt auf die Idee, H+ mit CO3 2- zu paaren und Ca2+ mit Cl-
- Woher weiß man, dass Cl- einfach aus der Gleichung verschwinden darf, weil es irrelevant war.
- Woher weiß ich, dass ich rechts Ca2+, H2O und CO2 haben muss.
Es fehlen mir irgendwie die Rechenvorschriften.
Das hab ich mir jetzt mit nüh und Not irgendwie zurecht gereimt, aber was ist, wenn in der Klausur am 4. März 2024, von 13.30 Uhr bis 15.30 Uhr in Hörsaal 1 eine andere Aufgabe mit dem gefürchteten Satz "Stellen Sie die Reaktionsgleichung auf". kommt. Da ist ja wieder alles komplett anders. Wie kann man lernen, Muster in so was zu erkennen.
oder bleibt einem nichts anderes übrig als letztlich jede Reaktionsgleichung auf der Welt auswendig zu lernen?
Liebe Grüße,
18Kesnej