Titration einer schwachen Säure: Warum entspricht im Halbäquivalenzpunkt der PH-Wert dem pKs-Wert?
Meine Überlegung:
Es gibt z. B. am Anfang 100 Mol von CH3COOH bei der Eduktseite Und nach der Gleichgewichtseinstellung gibt es 0,1 Mol CH3COO- (und H3O+) bei der Produktseite. (Was nicht stimmt, aber der Realität schon nah ist)
In diesem Zustand befindet die Probelösung, deren Konzentration zu ermitteln ist. (Angenommen, dass 100 Mol nicht bekannt ist)
Wenn man jetzt bei der Titration 1 Mol NaOH-Lösung zugibt (durch mehrere Tropfen), dann entsteht OH- -Ionen.
Dann reagieren zuerst 0,1 Mol OH- und 0,1 Mol H3O+ Ionen zu Wasser. Das bewirkt die Gleichgewichtsverschiebung, sodass mehr CH3COO- und H3O+ entstehen. Um die verbliebene Menge von OH- - Ionen, nämlich 0,9 Mol, weiter zu neutralisieren, reagieren im weiteren Verlauf auch zusätzliche 0,9 Mol CH3COOH-Moleküle mit Wasser (Weil es genug Wasser gibt, ist dessen Menge zu vernachlässigen) zu 0,9 Mol CH3COO- und H3O+.
Das heißt, wenn man 1 Mol NaOH zugibt, dann reagiert insgesamt 1 Mol CH3COOH zu CH3COO- und die verbliebene Menge von CH3COO- ist dann 1,1 Mol.
Weil bei der Produktseite tatsächlich viel weniger als 0,1 Mol CH3COO- gibt, kann man sagen, dass wenn man 1 Mol starke Säure in die Probelösung zugibt, genau so viel schwache Säure mit Wasser zum Säurerest (in diesem Fall CH3COO-) reagiert.
Schlussfolgerung: Wenn also die Hälfte der für die vollständige Dissoziation der schwachen Säure benötigte Menge von NaOH zugegeben wird (Halbäquivalenzpunkt), kann man gemäß der Begründung oben sagen, dass ca. genau die Hälfte der Ausgangskonzentration der schwachen Säure bei der Produktseite vorhanden sind. (Wenn die Ausgangskonzentration 1 Mol beträgt, dann ist es jeweils 0,5 Mol bei Edukt- und Produktseite)
Dann sind die Konzentration von H3O+ und von der schwachen Säure(die an der Eduktseite steht, in diesem Fall CH3COOH) gleich, sodass gilt:
Die HAC stammt von dieser Gleichung: HAC + H2O ⇌ AC- und H3O+)
Gibt es logische Fehler? Vielen Dank für Ihre Bemühung im Voraus.
2 Antworten

Ich kann Dir nicht ganz folgen. Am Anfang liest sich das noch überkompliziert aber ganz vernünftig, aber dann kommst Du auf mir nicht nachvollziehbare Art zum Schluß, daß am Halbäquivalenzpunkt c(HAc)=c(H₃O⁺) gilt, und das muß falsch sein: Denn eine 1 mol/l Essigsäure hat pH=½(pKₐ−lg(c))≈2.4, aber nach Deinen Ausführungen sollte am Halbäquivalenzpunkt c(H₃O⁾=0.5 mol/l und somit pH=0.3 sein. Daß eine Säure durch NaOH-Zugabe noch saurer wird, glaubst Du bestimmt nicht.
Wahr ist, daß am Halbäquivalenzpunkt die Hälfte der Säure verbraucht ist und zum Anion deprotoniert wurde; im Gleichgewicht ist also gleichviel Essigsäure wie Acetat vorhanden, daher kürzen sich im Massenwirkungsgesetz die beiden Konzentrationen heraus, und es verbleibt Kₐ=c(H₃O⁺) bzw. pH=pKₐ. Ich zeige Dir das einem Beispiel; meine Graphik zeigt die Titration von 20 ml 0.1 mol/l Essigsäure (pKₐ=4.75) mit 0.1 mol/l NaOH:
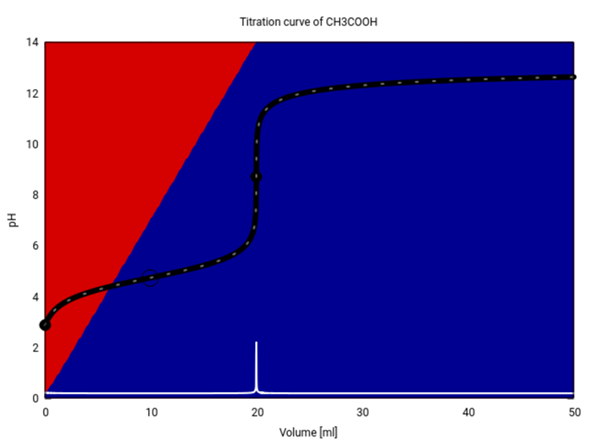
Die Titrationskurve und ihre erste Ableitung sind schwarz bzw. weiß eingezeichnet. Die Hintergrundfarben geben an, wieviel CH₃COOH (rot) und CH₃CO₂¯ (blau) im Gleichgewicht vorliegen. Wir starten mit ≈99% Essigsäure (weil die Säure nur schwach dissoziiert ist), und dieser Wert sinkt auf ≈0 am Äquivalenzpunkt. Am Halbäquivalenzpunkt (V=10 ml, Ring auf der Kurve) liegen Essigsäure und Acetat im Verhältnis 1:1 vor, daher gilt pH=pKₐ.
Bei einer stärkeren Säure wie Chloressigsäure (pKₐ=2.86) stimmt das nicht mehr so genau. Da bereits in der Probelösung ein merklicher Teil der Säure dissoziiert ist und folglich merklich Anion vorliegt, wird der Pufferpunkt (mit dem 1:1-Verhältnis) bereits ein kleines Stück vor dem Halbäquivalenzpunkt erreicht, in diesem Fall bei 9.6 ml.
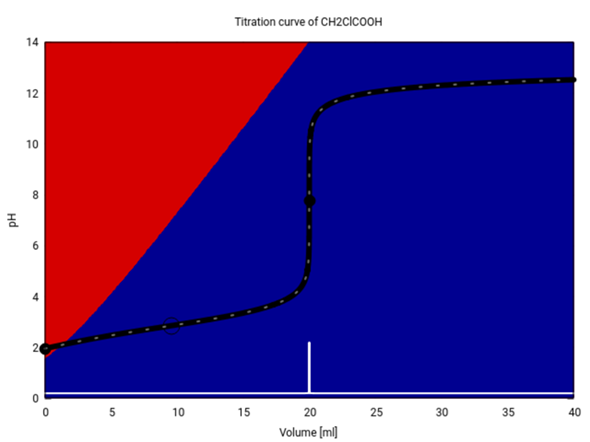
Für eine Säure, die bereits in der Probelösung zu mehr als 50% dissoziiert ist, kann der 1:1-Punkt, an dem pH=pKₐ gilt, natürlich niemals erreicht werden.

Nur um auf den Fragetitel einzugehen (den Rest habe ich nicht gelesen, weil sehr chaotisch): die Henderson-Hasselbalch-Gleichung kanntest du?
pH = pKs + lg([A-]/[HA])
Damit und den Logarithmengesetzen lässt sich deine Frage schon beantworten, denn lg(1) = 0.
Die Definition der schwachen Säure setzt doch schon voraus, dass angenähert nur HA vorliegt und somit [A-] nur von der zugegebenen Base abhängt. Und damit entspricht 50/50 gleich 50/50. Oder wo ist das Problem?