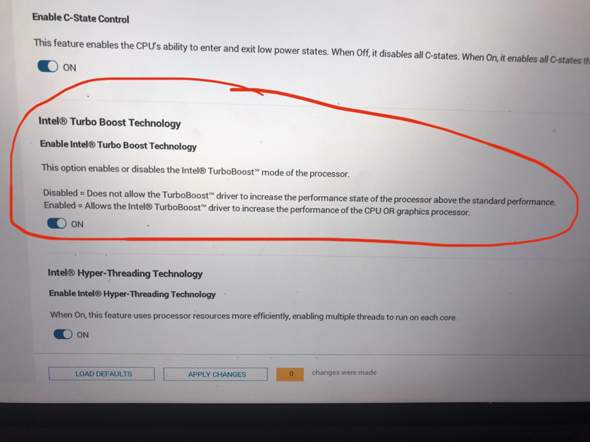
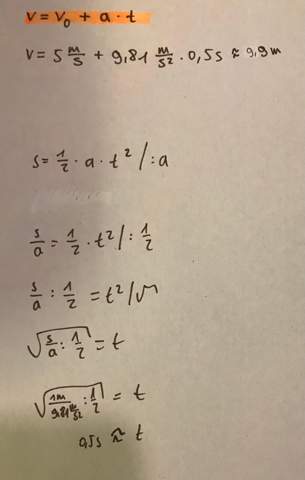Mit Anfang 21 ließ ich mich nach einem Lovoo-Getexte auf ein persönliches Kennenlernen mit meinem aktuellen Freund (welcher in Bezug auf Frauen,Beziehungen ebenfalls total unerfahren war sowie, ähnlich wie ich, nicht gerade charmant ist bzw. ähnliche Schwächen, Minderwertigkeitskomplexe,„Ängste“ etc. besitzt) ein. Trotz meines DAMALS sehr einsamen Lebens,zahlreicher blöd verlaufener Dates mit vielen Lovoo-Bekanntschaften sowie unsensibler Körbe entstand aus diesem verkrampften Kennenlernen zwischen mir und meinem jetzigen Partner eine scheinbar einigermaßen liebevolle Beziehung mit vielen gemeinsamen Unternehmungen, Spaziergängen,Strandurlauben u.a. Ein Ausbleiben von Komplimenten, Genieße-die-Tage-mit-dir-Aussagen,häufigem Kuscheln kam nach den ersten Monaten Bez. dennoch hinzu. Darüber hinaus meinte mein Freund kurz nach unserem Zusammenkommen mal: „Das ganze zwischen uns hätte ja auch anders enden können. Wäre ich nämlich oberflächlich, hätte ich dir nach dem 1.Treffen mitgeteilt,du seist mir zu schüchtern, anstatt dich weiterhin kennenzulernen“
Nun bin ich bereits 25 und studiere seit einigen Monaten ein recht zukunftssicheres Fach in einer (fremden) Kleinstadt
Kurz nach meinem Einzug in ein Zimmer eines Studentenwohnheimes entwickelte sich zwischen mir und einem auf den ersten Blick sehr bodenständigen Araber ein Gespräch,welcher bereits im 7.Semester WING studiert. Nachdem ich ihn einwenig (über meine Suche nach nem Impfzentrum sowie das Thema Studium) „vollgequatscht“ hatte, bot er mir seine Hilfe bei meiner Suche nach Links zu Impfzentren an und wir tauschten Nummern aus. Nach dem Zuschicken von Links entwickelte sich eine bescheidene WhatsApp-Kommunikation,welche zu einem freundschaftlichen,täglichen Chatten sowie einem Spaziergang führte. Da sich der Student bei diesem Spaziergang über seine depressive Verstimmung aufgrund des Todes seines besten Freundes ausweinte, ließ ich mich gegen Ende des Treffens auf ein Kaffee-Trinken bei ihm ein und versuchte ihn mit den Worten „Du kannst dich ja immer bei mir melden“ aufzubauen. Als wir bei nem weiteren Treffen kuschelnd unter seiner Decke lagen und ich mich somit unwohl fühlte,meinte er: „Du kommst mir so lieb,nett vor, dass mir das Kuscheln mit Dir echt gefehlt hätte. Da du jedoch vergeben bist und ich damit heute nicht gut umgehen kann,würde ich dir eher empfehlen,zu gehen. Wobei ich alle Momente mit Dir bisher genossen habe und diese zudem sehr schön fand“
Trotz seiner relativ kühlen,kumpelhaften Kommunikationsart auf WhatsApp sowie eher kurzen und knappen Antworten auf so gut wie jede von mir gestellte Frage zu SEINEM Leben,Ex-Partnerinnen,Familie hörte er mir bei jedem Treffen im Reallife weiterhin durchgehend zu, behandelte mich immer respektvoll, ging auf mich während meines gelegentlichen Ausweinens (bei ihm) über meine eigene Bez., Studium etc. stark ein und suchte zudem Körperkontakt,bis MICH seine ruhige,charmante,anziehende Art dazu brachte,mich auf Kuscheleien mit ihm einzulassen