freie Reaktionsenthalpie und Entropie?
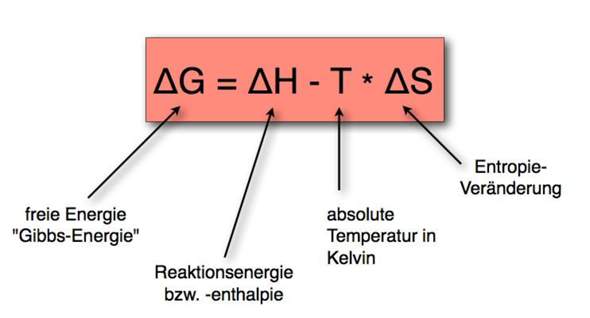
Das ist die Gibbs-Energie-Gleichung. Allerdings habe ich mich gefragt, auf was das H bezogen ist: Ist es auf die Umgebung bezogen oder auf das System? Wird bei einem negativen H in diesem Fall das System "kälter" oder die Umgebung?
- Und als was wird System (in einfacheren Wörtern) genau definiert? Also einfach z.B das Reagenzglas, in dem die Reaktion stattfindet?
Und dann noch zur Entropie: Wieso ist die gesamte Entropie im Universum nicht konstant? Wenn z.B. im System die Entropie zunimmt, dann nimmt sie doch in der Umgebung wegen der verlorenen Wärme z.B. ab?
3 Antworten

Allerdings habe ich mich gefragt, auf was das H bezogen ist: Ist es auf die Umgebung bezogen oder auf das System?
Es wird grundsätzlich immer alles aus Sicht des Systems und nicht aus Sicht der Umwelt betrachtet.
Wird bei einem negativen H in diesem Fall das System "kälter" oder die Umgebung?
Da die Enthalpie aus Sicht des Systems betrachtet wird, bedeutet ein negatives Vorzeichen, dass die Enthalpie im System geringer wird. Das passiert z.B., wenn Wärme aus dem System in die Umgebung fließt. Das System wird dann kälter. Die Umgebung ist so definiert, dass sie unendlich groß sei, sodass ihr eine Wärmezufuhr oder ein Wärmeentzug nichts ausmacht und sie ihre Temperatur dennoch konstant hält. Das ist auch durchaus plausibel. Wenn es z.B. im Winter draußen minus 10 °C hat und du führst im Chemiesaal bei offeneme Fenster eine exotherme Reaktion durch, wird es dennoch draußen nicht messbar wärmer.
Und als was wird System (in einfacheren Wörtern) genau definiert?
Dafür gibt es keine feste Regeln. Da ist man völlig frei. Man sollte die Systemgrenze aber möglichst so legen, dass man mit möglichst einfachen Rechnungen ein gesuchtes Ergebnis erhält.
Also einfach z.B das Reagenzglas, in dem die Reaktion stattfindet?
Genau, das wäre eine typische und oft sinnvolle Festlegung der Systemgrenzen.
Und dann noch zur Entropie:
Zur Enthlapie und Entropie allgemein und wie sie zu verstehen sind, habe ich hier schon mal sehr ausführlich etwas geschrieben:
https://www.gutefrage.net/frage/enthalpie-und-entropie#answer-424230150
Wieso ist die gesamte Entropie im Universum nicht konstant?
Das war in der Tat lange Zeit ein großes Rätsel und dessen Lösung kennen selbst die meisten Lehrer nicht. Beantwortet hat diese Frage Ilya Progine mit der Theorie Dissipativer Strukturen, für die er 1977 den Nobelpreis in Chemie erhielt. Denmnach ist es so, dass der Zeitpfeil und die Produktion von Entropie unmittelbar zusammenhängen. Wenn die Zeit voranschreitet, entsteht zwangsläufig Entropie bzw. umgekehrt, wenn Entropie erzeugt wird, schreitet damit auch die thermodynamische Zeit voran. Um Entropie zu vernichten, müsste die Zeit rückwärts laufen. Der real existierende Zeitpfeil und die Produktion von Entropie sind zwei Seiten von ein- und derselben Medaille.
Anderer Ansatz: da Entropie ein Maß dafür ist, wie weit hochwertige Enregie, also z.B. Gravitatiosenergie, bereits entwertet wurde, also in Richtung Wärme umgewandelt wurde und im Universum überall und ständig Energieentwertungen stattfinden, nimmt zwangsläufig auch die Entropie zu. Die Entropie in unserem Universum könnte nur dann abnehmen, wenn es sich in einer "Umgebung" befinden würde, in die die Entroie exportiert werden könnte. Da wir aber noch nicht einmal wissen, wo die Grenzen des Universums liegen und was an den Grenzen passiert und erst recht nicht wissen, ob es hinter den Grenzen noch etwas gibt, ist das reine Spekulation.
Nochmal zur Entropie im Universum: Ilya Prigogine hat in seiner Theorie Dissioativer Strukturen beschrieben, dass die größte dissioative Struktur, die das Universum bislang erlebt hat, etwa 380.000 Jahre nach dem Urknall stattfand. Da kondensierte die Energie, die bis dato im unduchsichtigen Universum vorhanden war, zu der Materie, die wir heute kennen und aus der alles sichtbare aufgebaut ist. Alleine bei diesem Prozess wurde die Hälfte aller heute im Universum vorhandenen Entropie erzeugt. Diese wurde in Form der Hintergrundstrahlung an das Universum abgegeben, die das gesamte Universum durchflutet und eine Temperatur von rund 2,725 K besitzt. In dieser Temperatur steckt die damals erzeugte Entropie. Mit jeder weiteren Entropieerzeugung steigt die Temperatur des Universums weiter an.
Wenn z.B. im System die Entropie zunimmt, dann nimmt sie doch in der Umgebung wegen der verlorenen Wärme z.B. ab?
Das kann man so nicht sagen. Wärme ist sozusagen der Abfallhaufen der Energie. Wärme ist der Träger und der Transporteur von Entropie. Nur wenn Wärme von der Umwelt in des System fließen würde, könnte die Entropie in der Umgebng abnehmen. Die Entropie im System würde dann aber überproportional zunehmen, da jeder reale Wärmetransport seinerseits wieder neue Entropie produziert.
Egal ob man eine endotherme oder eine exotherme Reaktion hat, hat man in der Summe hinterher mehr Entropie als vorher.

Ein negativer Wert für DeltaH meint per Konvention Reaktionsenergie die freigesetzt wird. Was dein System ist, bestimmst du, die Hauptsache ist, dass es über 2 Zustände verfügt, deren Differenz hinsichtlich Enthalpie und Entropie bekannt ist. Das kann z. B. eine chemische Reaktion sein.
Wieso ist die gesamte Entropie im Universum nicht konstant?
Man weiß nicht, ob das so ist oder nicht so ist.
Der 2. Hauptsatz der Thermodynamik besagt in einer Formulierung, dass die Entropie in einem geschlossenen adiabaten System nicht sinken kann. Darüber lassen sich keine Aussagen über das Universum als ganzes treffen. Die Hauptsätze der Thermodynamik sind reine Erfahrungssätze und damit von vornherein ungeeignet Aussagen über das Universum zu treffen, dass uns in seiner Gänze völlig unbekannt ist.

1. Das H ist üblicherweise auf das System bezogen, ein negatives ΔH bedeutet eine Enthalpieabnahme. Eine Temperaturänderung muss überhaupt nicht statt finden, ich weiß nicht, worauf du damit hinaus willst.
2. Ein System ist einfach alles innerhalb einer Bilanzgrenze. Du kannst sowohl ein Reagenzglas als auch einen Raum mit einem Reagenzglas drin als System betrachten, solange du die Grenzen vernünftig definierst.
3. Die gesamte Entropie ist nicht konstant, weil Entropie erzeugt (aber nicht vernichtet) wird. Aus Arbeit kann Wärme werden, aber aus Wärme nicht mehr vollständig Arbeit.