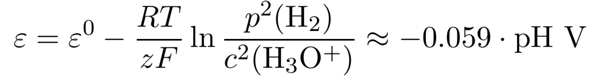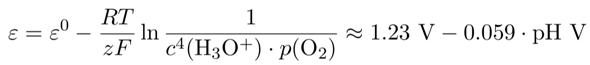E(H2O|H2)?
Wenn ich in die Tabelle im Buch gucke, finde ich nur -0,83 V als Abscheidungspotenzial für die Reaktion. Warum ist der hier anders? Und auch bei der Oxidation von Wasser (weiter unten) finde ich nur den Wert 1,23 V… Aber die haben hier ja nicht gekürzt oder so. Die Überspannungsanteile werden auch erst auf diese Werte addiert. Warum sind das dann andere Werte?

Was ist η(H₂)?
Überspannung
1 Antwort
Du willst mir nicht sagen, was das η bedeuten soll. Deshalb rate ich, daß es die Überspannung ist.
Als erstes willst Du entscheiden, ob an der Kathode Natrium oder H₂ gebildet wird. Dazu brauchen wir einmal das Natriumpotential ε⁰(Na⁺/Na)=−2.71 V, und andererseits das Wasserstoffpotential. Das Standardpotential ist natürlich ε⁰(H₃O⁺/H₂)=0 V für die Reaktion
2 H₃O⁺ + 2 e¯ ⟶ H₂ + 2 H₂O
aber das gilt eben bei Standardbedingungen, also c(H₃O⁺)=1 mol/l bzw. pH=0. Du hast aber eine Natriumfluoridlösung, die ist in der Praxis leicht alkalisch (pH≈8.6), aber aus irgendeinem Grund ist die Rechnung trotzdem auf pH=7 ausgelegt. Das wirft die Frage auf, wie man das Wasserstoffpotential auf pH=7 umrechnen kann. Die Antwort bietet die Nernstsche Gleichung, die man folgendermaßen umschreiben kann, wenn man die Konstanten und Logarithmen zusammenfaßt und p(H₂)=1 bar setzt:

Für pH=7 kriegst Du −0.41 V, also genau die Zahl, die bei Dir angegeben ist. Zusammen mit der Überspannung ergibt sich dann ein Abscheidepotential −0.41−0.23=−0.64 V, das ist viel näher an Null als beim Natrium, also wird H₂ gebildet.
An der Anodenseite ist es ziemlich ähnlich: Das Fluorpotential ε⁰(F₂/F¯)=+2.85 V ist pH-unabhängig, nur beim Sauerstoff müssen wir wieder aufpassen: Das Standardpotential ε⁰(O₂/H₂O)=+1.23 V bezieht sich auf die Reaktion
O₂ + 4 H₃O⁺ + 4 e¯ ⟶ 6 H₂O
und gilt folglich wieder bei pH=0, zum Umrechnen nehmen wir die Nernstsche Gleichung und versuchen wieder zu vereinfachen:

Und wenn Du da einsetzt, bekommst Du das Sauerstoffpotential in neutraler Lösung als ε=+0.81 V, und da kommt noch die Überspannung dazu zu einem Abscheidepotential von +1.67 V, und das liegt näher an Null als der Wert fürs Fluor, also wird sich O₂ bilden.
(eigentlich hätte ich auch noch eine Überspannung für Fluor erwartet)