Doppelbindung bei Eliminierung immer Z-Konfiguriert?
Wir verstehen gerade nicht warum bei folgender Eliminierung nur das Hoffmann-Produkt gebildet wird und das Saytzeff-Produkt peu a peu flöten geht.
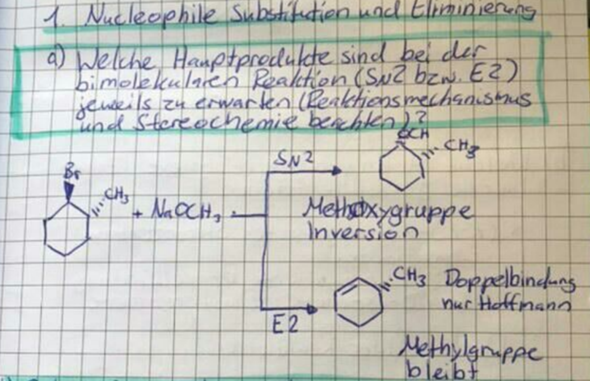
Schon klar, das Brom verschwindet und das H am Kohlenstoff-Atom oben links klappt nach innen rein. Aber oben rechts, an dem C-Atom wo die Methylgruppe hängt, hängt doch eigentlich auch noch ein H. Das könnte man doch auch reinklappen, oder.
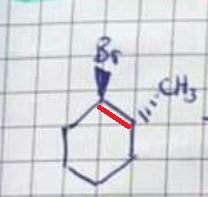
Frage 1: Warum geht das nicht?
Jetzt steht in der Lösung aber "Doppelbindung: nur Hoffmann"
Etwas weiter unten folgt dann die Auflösung:

Hääää? Das versteh' ich überhaupt nicht. Wir haben in der Vorlesung gelernt: "Bei Eliminierungen gilt die Hofmann-Regeln: Die Eliminierung findet so statt, dass die DOppelbindung immer Z-konfiguriert ist"
Z heißt ja, dass die Striche zu den C-Atomen [also die Substituenten] die an der Doppelbindung hängen, in diesselbe Richtung zeigen (Z = Zusammen).
Jetzt steht hier: "E2 erfordert "antiperiplanare" trans-Stellung von H / Br". Häää? trans heißt doch entgegen und entgegen heißt E-konfiguriert. Der widerspricht sich doch die ganze Zeit selbst🥴
Frage 2: Also ich habe jetzt aus der Diskussion mitnehmen können, daß Eliminierung immer so stattfindet, daß die Doppelbindung Z-konfiguriert ist. Gleichzeitig darf ich hier bei dieser Aufgabe nur das Hoffmann-Produkt bilden, weil die Eliminierung eine E-Konfiguration von H und Br erfordert. Stimm das so?
So, jetzt hatten wir aber auch mal eine andere Übungsaufgabe gehabt, wo man eine Eliminierung von Chlor durchführen muss bei Ethanolamin (2-Aminoehanlol). Da kam dann folgendes raus
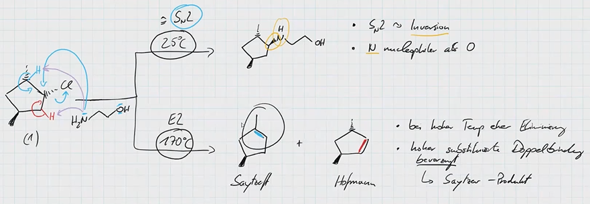
Hääää? Da ist geht jetzt auf einmal wieder das Saytzeff-Produkt. Obwohl wir doch gerade gelrnt haben, daß bei Elimierung immer die Hoffmann-Regel gilt und die Doppelbindung Z-konfiguriert ist. Aber hier haben wir ja das Saytzeff-Produkt und das ist jetzt E-konfiguriert.
Wir sind jetzt alle total verwirrt, ob es jetzt wirklich so ist wie in der oberen Aufgabe, also dass man nur das Z-konfigurierte Hoffmann-Produkt nehmen soll oder auch das E-konfigurierte Saytzeff.
Frage 3:Warum nimmt man oben nur Hoffmann und unten Hoffmann und Satyzeff?
Kann da bitte jemand kurz Licht ins Dunkeln bringen?
Danke und einen schönen sonnigen Dienstagnachmittag
2 Antworten
Frage 1: Warum geht das nicht?
Jetzt steht in der Lösung aber "Doppelbindung: nur Hoffmann"
Für die Bildung einer Doppelbindung müssen die p-Orbitale der zwei benachbarten Kohlenstoffatome sich direkt gegenüberstehen (das ist das was mit antiperiplanar gemeint ist). Also H und Br müssen sich hier gegenüber stehen. Sieht man hier ganz gut, auch mit den Orbitalen. Syn Stellung geht normalerweise auch, aber syn ist im Nromalfall schon energetisch ungünstiger als anti und hier hast du zusätzlich noch die Ringspannung, die eine syn-Stellung quasi ganz verhindert.
Hier bildet sich deswegen auch nur das Hofmann-Produkt, weil sich das Saytzeff-Produkt schlicht nicht formieren kann. Denn in antiperiplanarer Stellung sitzt die Methylgruppe. Und die kann sich wegen dem Ring nicht einfach wegdrehen wie bei normalen Alkanen. Siehe hier
Bei Eliminierungen gilt die Hofmann-Regeln: Die Eliminierung findet so statt, dass die DOppelbindung immer Z-konfiguriert ist
Das stimmt so nicht. Hofmann und Saytzeff sagt etwas über die Stabilität des Produkts/Übergangszustands und ist auch von den Reaktionsbedingungen wie z.b. der Größe der verwendeten Base abhängig. Die Konfiguration des Produkts ist dabei voll egal.
weil die Eliminierung eine E-Konfiguration von H und Br erfordert. Stimm das so?
Jein. syn- und antiperiplanar ist nicht dasselbe wie E und Z, in diesem Fall mehr oder weniger schon, aber allgemein gilt das nicht. Und wie gesagt, Z bzw syn Eliminierung gibt es auch.
Die von mir vorgeschlagene Variante hätte doch genau den gleichen Winkel, nur halt auf der gegenüberliegenden Seite.
Hat sie nicht. Du gehst davon aus, dass der Ring planar ist. Das ist er aber nicht. Schau dir nochmal das an. Das ist dieselbe Konfiguration wie bei deiner Aufgabe, nur eben statt Brom Chlor und statt Methylrest ein Isopropylrest. Da kann keine Eliminierung stattfinden, weil die Methylgruppe (im Link die Isopropylgruppe) da sitzt wo das H sein müsste für eine erfolgreiche Eliminierung.
aber Du behauptest jetzt, daß die Aussage "Bei Eliminierungen gilt die Hofmann-Regel: Die Eliminierung findet so statt, dass die DOppelbindung immer Z-konfiguriert ist"" ebenfalls falsch ist?
Ja. E/Z Konfiguration ist egal. Denn 1. entsteht das Saytzeff-Produkt weil der Übergangszustand stabiler ist als beim Hofmann Produkt und der Übergangszustand hat keine Konfiguration. Demnach ist die auch egal. Und 2. kann man mit der Hofmann Eliminierung auch trans bzw E konfigurierte Produkte herstellen, siehe trans-Cycloocten. Letzteres allein macht diese Aussage schon falsch.
Außerdem gibt es ja Saytzeff-Produkte die sowohl E als auch Z konfiguriert sein können, bzw Produkte die nichts davon sind, weil es keine E/Z Isomerie bei ihnen gibt.
Tipp an der Stelle noch: Bei solchen Problemen lohnt sich immer ein Blick in Lehrbücher. In einem guten Lehrbuch ist das verständlich erklärt und im bestem Fall visuell aufgearbeitet. Das hat mir immer sehr geholfen.
Du schmeißt da viel durcheinander. Und zufällige Texte in Fremdsprachen machen deine Fragen auch nicht leichter verständlich. Ich verstehe die Frage nicht ganz und antworte aus Zeitgründen nur allgemein.
Zum Cyclohexan: geht glaube ich nicht, weil der Ring erstens nicht planar ist (äquatorial/axial) und zur Eliminierung ein 180°-Winkel benötigt wird.
Die Hofmann-Regel kenne ich als Umkehrung der Saytzeff-Regel: entweder wird die zugänglichere Stelle deprotoniert (bei fetten, starken Basen) oder das stabilere 2-Alken gebildet wird (bei schwachen, dünnen Basen und guten Abgangsgruppen).
Es gibt noch die Woodward-Hoffmann-Regel, das ist etwas völlig anderes. Verwechselst du die?
Das andere ist die E/Z-Orientierung. Tendenziell ist trans etwas stabiler. Man argumentiert über Ringspannung, Rotamerenergien usw. Siehe 0°/180°-Winkel.
Beides ist qualitativ, es entstehen immer Produktgemische!
daß Eliminierung immer so stattfindet, daß die Doppelbindung Z-konfiguriert ist
Klingt nach Kokolores, müsste ich aber nachschauen.
Beim unteren Beispiel stehen Methyl und Chlor syn, ~180°-Angriff ist möglich... Sn2 sollte auch möglich sein, ist mit Alkoholat aber unwahrscheinlich.
Fazit: du hast vermutlich ein Problem mit Ringkonformationsbestimmung.
Danke für die Antwort. Zum Cyclohexan: Du schreibst, das zur Eliminierung ein 180 Grad-Winkel benötigt wird, aber die Methlgruppe und Brom sind doch im 180 Grad-Winkel,oder? Zumindest sind sind im unteren Beispiel die Methylgruppe und Chlor im gleichen Winkel und da sagst du ja, 180-Grad-Angriff wär möglich.
Die Achsen C-Br und a-C-H, nicht C-CH3, müssen in einer Ebene liegen, d. h. 0 oder 180°.
Diese Stelle ist aber durch die Methylgruppe blockiert. Das tertiäre Proton geht nicht ab. Daher entsteht nur das wenig substituierte Cyclohexen.
Schau dir die Winkel und Konformation in 4- bis 6-Ringen nochmal an, äquatorial und axial.
Zunächst einmal vielen Dank für die Erklärung. Eins versteh ich noch nicht so ganz:
Bei dem Hoffmann-produkt (also das was möglich ist); ist das H ja am linken Kohlenstoff-Atom, vom Kohlenstoff-Atom mit dem Brom ausgesehen. Die von mir vorgeschlagene Variante hätte doch genau den gleichen Winkel, nur halt auf der gegenüberliegenden Seite. Also in der Lösung wird eben das H am Kohlenstoff-Atom links vom Kohlenstoff mit dem Brom umgeklappt und in meinem Fantasie-Vorschlag das H am Kohlenstoff-Atom rechts vom Kohlenstoff-Atom mit dem Brom. Die Seite ist nur gegenüberliegend, der Winkel ist der gleiche.
Der Satz steht so bei uns 1: 1 in den Lösungen. Das war eine Multiple Choice - Aufgabe und man musste ankreuzen welche AUssage wahr ist. Bei den wahren AUssagen wurde folgendes angekreuzt
Als falsche Antworten gab es nch:
Die letzteren beiden Antworten sind natürlich Kakolores (Es muss genau umgekehrt sein!), aber Du behauptest jetzt, daß die Aussage "Bei Eliminierungen gilt die Hofmann-Regel: Die Eliminierung findet so statt, dass die DOppelbindung immer Z-konfiguriert ist"" ebenfalls falsch ist?