1. Hauptsatz der Thermodynamik und Ammoniaksynthese?
Hallo liebe Leute,
ich habe eine Frage zur folgenden Aufgabe:
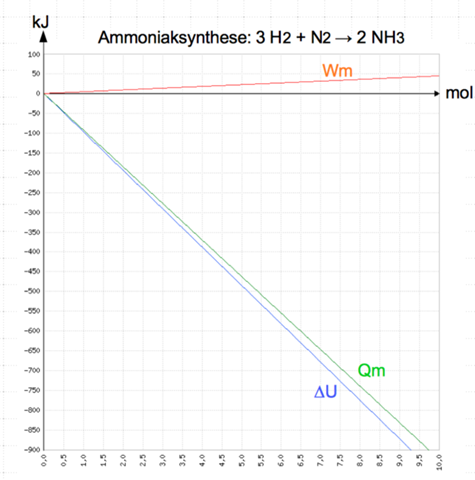
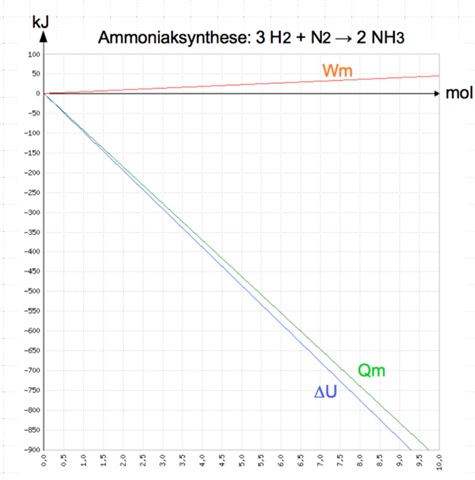
Die Herstellung von Ammoniak ist eine sehr wichtige Reaktion . Unter Normalbedingungen ( p = 101,3kPa ) beträgt die molare Reaktionsenergie für diese Reaktion ∆rUm = -92,4kJ•mol-¹ , die molare Volumenarbeit Wm=+4,5 kJ•mol-¹. Erläutern Sie an dieser Reaktion den ersten Hauptsatz der Thermodynamik und zeichnen Sie ein Diagramm zur Änderung der inneren Energie bei dieser Reaktion.
Also ich habe versucht den 1. Hauptsatz der Thermodynamik zu erläutern und das habe ich geschrieben:
Die Aussage des 1. Hauptsatzes der Thermodynamik lautet: Energie kann nicht vernichtet oder erzeugt werden. Sie kann lediglich von einer in eine andere Form überführt werden. Diese Energieerhaltung bedeutet, dass eine bestimmte Energiemenge ihre Erscheinungsform ändert. Sie ist also beispielsweise als Innere Energie U in einem Stoff gespeichert und kann durch eine chemische Reaktion als Wärmeenergie bemerkt werden. Dabei nimmt die Innere Energie um den gleichen Betrag ab, wie Wärmeenergie freigesetzt wird.
Nun komme ich aber leider nicht weiter und weiß nicht wie ich den 1. Hauptsatz der Thermodynamik an der Ammoniaksynthese erläutern soll. Und außerdem kann ich mit der Frage bezüglich des Diagramms nichts anfangen.
Ich würde mich auf hilfsreiche Antworten sehr freuen.
Danke im Voraus!
Viele Grüße
1 Antwort
Die Aussage des 1. Hauptsatzes der Thermodynamik lautet: Energie kann nicht vernichtet oder erzeugt werden. Sie kann lediglich von einer in eine andere Form überführt werden.
So weit, so gut, aber dann wirds falsch.
Weiter könnte es gehen:
Energieerhaltung bedeutet, dass die Summe aller Energien konstant bleibt und sich innerhalb dieser konstanten Summe lediglich die Erscheinungsformen der Energien ändern können.
Sie ist also beispielsweise als Innere Energie U in einem Stoff gespeichert und kann sich durch eine chemische Reaktion in Wärme und Volumenänderungsarbeit umwandeln. Dabei gilt:
ΔU = Q + Wv
Dabei ändert sich die Innere Energie U um denselben Betrag, wie die Summe aus freigesetzter Wärme und verrichteter Volumenänderungsarbeit.
Die Reaktionsgleichung der Ammoniaksynthese lautet:
3 H2 + N2 → 2 NH3
Die Energiegleichung lautet:
ΔrUm = Qm + Wm
in Zahlen:
-92,4kJ•mol-¹ = Qm + 4,5 kJ•mol-¹
aufgelöst nach Qm:
Qm = 92,4kJ•mol-¹ - 4,5 kJ•mol-¹ = - 96,9 kJ/mol
Das Minuszeichen bedeutet, die Reaktionswärme bzw. Reaktionsenthalpie wird freigesetzt.
Als Diagramm könnte ich mir das so vorstellen: