was ist der 2. Äquivalenzpunkt?
Ich verstehe nicht, was bei einer dreiprotonigen Aminosäure der 2. Äquivalenzpunkt bedeutet? der erste ist ja, wenn die cooh Gruppen neutralisiert wurden, aber wofür der 2.? Und kennt jemand Seiten, wo ich die Titrationskurve von Cystein und Tyrosin herausfinde?
1 Antwort
Mir ist nicht klar, was Du mit einer „dreiprotonigen Amonosäure“ meinst. Vielleicht so etwas wie Glutaminsäure oder Asparaginsäure? Die haben drei Dissoziationsstufen. Aber normalerweise werden sie als Neutralsubstanzen (mit der Aminosäure-COOH-Gruppe deprotoniert) oder als Salze eingesetzt (mit beiden COOH-Gruppen deprotoniert), und dann sind sie natürlich nur noch zwei- bzw. einbasig.
Beispiel Asparaginsäure: Die vollständig protonierte Form ist ein Kation (weil die NH₂-Gruppe protoniert ist und läßt sich zum Neutralteilchen (Zwitterion) deprotonieren, pKₐ=2.19.
HOOC–CH₂CH₂–C(NH₃⁺)–COOH + OH¯ ⟶ HOOC–CH₂CH₂–C(NH₃⁺)–CO₂¯ + H₂O
Jetzt haben wir also aus dem Kation (das man Hydrochlorid auch kristallisieren kann) die neutrale Glutaminsäure gemacht. Diese kann ein weiteres H⁺ abgeben (pKₐ=4.25) und geht in das Zwitterion über, das man auch einfach als Glutaminsäure bezeichnet:
HOOC–CH₂CH₂–C(NH₃⁺)–CO₂¯ + OH¯ ⟶ ¯O₂C–CH₂CH₂–C(NH₃⁺)–CO₂¯ + H₂O
Das ist die Form, in der die Glutaminsäure meist in den Handel kommt, nämlich als Natriumsalz. Als Säure ist es schwach (pKₐ=9.67) , aber man kann es weiter zum Dianion deprotonieren.
¯O₂C–CH₂CH₂–C(NH₃⁺)–CO₂¯ + OH¯ ⟶ ¯O₂C–CH₂CH₂–C(NH₂)–CO₂¯ + H₂O
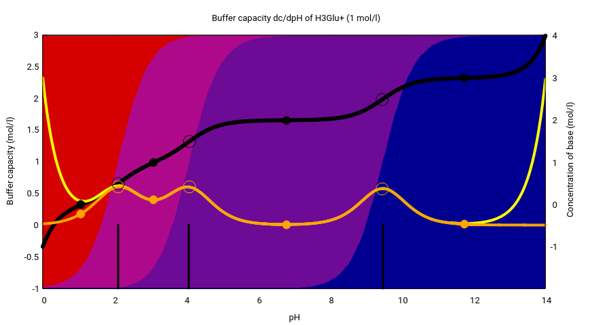
Wir haben also das Kation, das Zwitterion, das Anion und das Dianion. Je nach pH liegt das Molekül in verschiedenen Formen vor, die in dieser Graphik als Hintergrundfarben von rot bis blau codiert sind; die pKₐ-Werte sind als Striche am unteren Rand eingezeichnet, die Kurven kannst Du ignorieren. Im Neutralen dominiert das Anion.

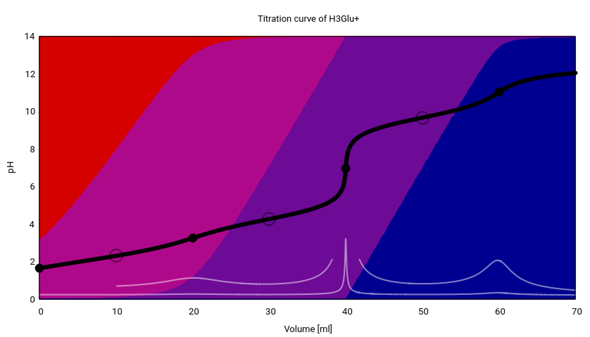
Die Titrationskurve kannst Du hier sehen. Wir beginnen mit dem Kation und titrieren das bis zum Dianion. Eingesetzt werden 20 ml einer 0.1 mol/l Lösung aus dem Hydrochlorid, oder äquivalent Natriumglutamat+HCl, und titriert wird mit 0.1 mol/l NaOH. Die schwarze Kurve ist die Titrationskurve, die weiße (mit Vergrößerungen) die erste Ableitung davon, außerdem sind Äquivalenz- und Pufferpunkte eingezeichnet.

Aber nochmals: Die Handelsform ist meistens das Natriumsalz, also das Blauviolette in der Graphik. Wenn Du das titrierst, dann fängst Du dort an, wo ich in dieser Graphik bereits 40 ml verbraucht habe (es hat nur noch einen verbleibenden Äquivalenzpunkt).
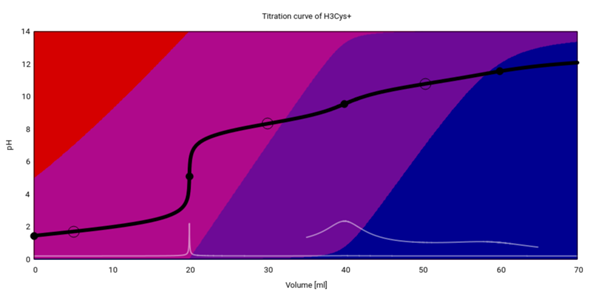
Als nächstes willst Du Cystein haben. Das ist im Prinzip gleich, aber die voll saure Form ist auch hier positiv geladen, und dann werden der Reihe nach die COOH-Gruppe (pKₐ=1.71), die SH-Gruppe (pKₐ=8.33) und die NH₃⁺-Gruppe (pKₐ=10.78) deprotoniert.

Du siehst, daß der zweite Äquivalenzpunkt kaum und der dritte gar nicht zu sehen ist.
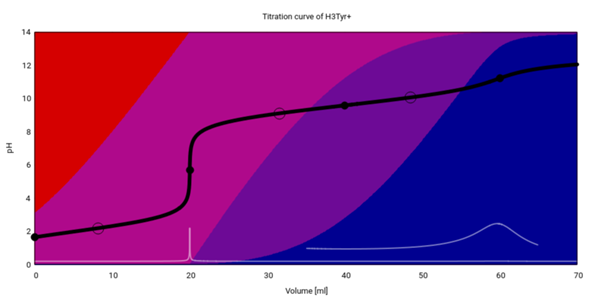
Zuletzt Tyrosin, das hat eine saure Phenolgruppe. Hier ist aber die NH₃⁺-Gruppe eine Spur saurer (pKₐ=9.11) als das Phenol (pKₐ=10.07), und deshalb wird sie zuerst deprotoniert, aber mit Überlappung, weil sich die Säurestärken nicht sehr unterscheiden:

Auch hier sind die beiden hinteren Äquivalenzpunkte kaum zu sehen; der zweite ist vollkommen verdeckt vom Pufferbereich, der sich daraus ergibt, daß hier drei verschieden protonierte Spezies (zwei Paare von konjugierte Säure/Base) nebeneinander in der Lösung herumschwimmen.