pH Bereich von Indikatoren?
Hallo!
Ich habe folgendes gelesen: Der pH Bereich, in dem die Farbe eines Indikators umschlägt, liegt immer beim pKs Wert der schwachen Säure.
Kann mir das jemand erklären?
Danke im Voraus
1 Antwort

Bei allen Säuren gilt: Wenn man eine kleine Menge davon in eine Lösung mit irgendeinem pH-Wert schüttet, dann liegt diese Säure deprotoniert vor (also in der Basenform), wenn pH≫pKₐ, und umgekehrt protoniert (in der Säureform) wenn pH≪pKₐ.
(ich habe „eine kleine Menge geschrieben“, damit der pH der Lösung vom Zusatz der neuen Säure nicht merklich beeinflußt wird)
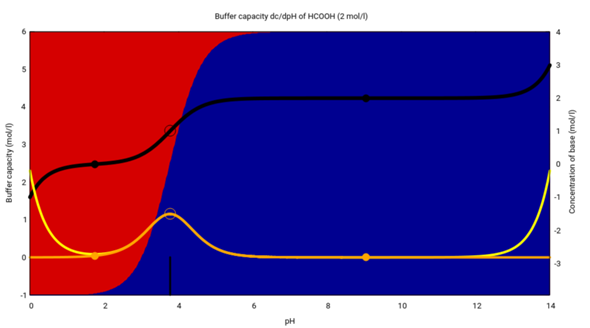
Alles hängt also von der Säurekonstante (dem pKₐ) ab. Hier zeige ich es Dir für Ameisensäure:
Diese Graphik zeigt ziemlich viel und mehr als Du haben willst. Auf der x-Achse ist der pH-Wert aufgetragen, und die Hintergrundfarben rot/blau stenen für die jeweiligen Anteile Ameisensäure HCOOH und Formiat HCO₂¯ im Gleichgewicht. Der pKₐ-Wert beträgt 3.77 (schwarze Markierung am unteren Rand), und Du siehst, daß in Lösungen, die saurer sind als 3.77 die Ameisensäure (rot) im Gleichgewicht dominiert, in alkalischeren Lösungen dagegen das Formiat (blau).
(Diese Gesetzmäßigkeiten kommen aus dem Massenwirkungsgesetz und gelten für alle Säuren. Natürlich gibt es sehr starke Säuren wie HCl (pKₐ≈−6), die immer vollständig dissoziiert (also in Form der Base, in diesem Fall Cl¯, vorliegen)sind, weil es einfach keine wäßrige Lösung gibt, die sauer genug wäre, das zu unterbinden — es gibt ja keine wäßrige Lösung mit pH=−6.)
Wenn Ameisensäure und Formiat verschiedene Farben hätten, dann könnte man Ameisensäure also als Indikator verwenden; für pH≪3.77 würde man eine andere Farbe sehen als für pH≫3.77. Leider sind aber beide farblos, zumindest für unsere Augen, daher ist Ameisensäure kein brauchbarer Indikator.
Und jetzt solltest Du verstehen, was ein Indikator ist: Das ist einfach eine Säure mit einem pKₐ-Wert zwischen 0 und 14, bei der die Säure und ihre konjugierte Base verschiedene Farbe haben (in der organischen Chemie kommen solche Vögel häufig vor). Bei pH≪pKₐ sieht man die Säurefarbe, bei pH≫pKₐ sieht man die Basenfarbe, und rund um den pKₐ gibt es einen Bereich (etwa pKₐ±1), in dem die Farbe gemischt aussieht weil die Säure- und Basenform des Indikators in ungefähr gleichen Mengen vorliegt.