Chemie frage?
Hi, ich habe eine Frage.
Es gibt ja die Formel für schwache Säuren. pH = ½ (pKs - log cHA)
Woher weiß ich, wann eine Säure schwach, bzw. Stark ist? Wird das in der Aufgabe vorgegeben? Oder muss ich erstmal den ph Wert berechnen? Wenn ich aber nicht weiß ob es eine schwache Säure ist und dann die andere Formel verwende?
3 Antworten

Von mir kriegst Du die richtige Antwort, die aber ein bißchen komplizierter ist.
Für den Zweck dieser Formel bedeutet „schwach“, daß die Säure nur wenig dissoziiert ist — in der Lösung sollten also höchstens ein paar Prozent der Säuremoleküle als Anion vorliegen, der Rest als undissoziierte Säure. Dann und nur dann gibt diese Formel den richtigen pH-Wert.
Ob Eine Säure in der Lösung als Säuremolekül oder als Anion vorliegt, hängt aber von ihrer Säurekonstante, angegeben als pKₐ=−lg(Kₐ), und außerdem vom pH ab.
- Wenn pKₐ ≪ pH, dann ist die Säure vollständig dissoziiert also stark
- Wenn pKₐ ≈ pH dann ist die Säure teilweise dissoziiert also mittelstark
- Wenn pKₐ ≫ pH dann ist die Säure kaum dissoziiert also schwach
Hier beißt sich die Katze aber in den Schwanz, denn den pH wollen wir ja erst berechnen; wir wissen aber immerhin, daß er für eine wäßrige Säurelösung im Bereich
0 ≤ pH ≤ 7 liegen muß. Falls pKₐ<0 wissen wir sofort, daß die Säure sehr stark und daher vollständig dissoziiert sein muß, und zum Berechnen des pH-Wertes nehmen wir dann die Formel pH=−lg(c); falls pKₐ>7 wissen wir daß sie kaum dissoziiert sein wird und wir können unbesorgt die Formel pH = ½(pKₐ−lg(c)) nehmen.
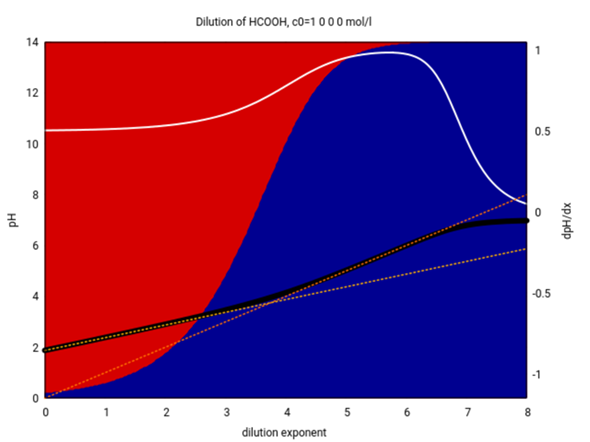
Für Säuren mit pKₐ zwischen 0 und 7 hängt der Dissoziationsgrad von der Konzentration ab; je konzentrierter die Säure ist, umso weniger ist sie dissoziiert (sie ist also schwach), aber bei hoher Verdünnung steigt die Dissoziation, und die Säure verhält sich plötzlich wie eine starke Säure. Die folgende Graphik zeigt das für Essigsäure:
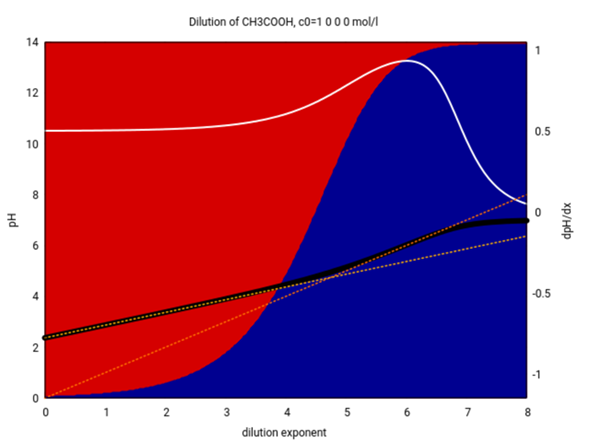
Hier sieht man einen Haufen:
- Auf der Abszisse ist die Verdünnung logarithmisch aufgetragen (c=10⁻ˣ mol/l). Der Abzissenwert 2 entspricht also 10⁻² = 0.01 mol/l
- Die schwarze Kurve zeigt den pH-Wert einer Essigsäure mit genau dieser Konzentration.
- Die Hintergrundfarben geben den Dissoziationsgrad an (rot für undissoziierte Essigsäure, blau für Acetat). Du siehst, daß für konzentrierte Lösungen bis etwa 0.001 mol/l die Essigsäure nur wenig dissoziiert; sehr verdünnte Lösungen von 10⁻⁶ mol/l sind allerdings fast vollständig dissoziiert (in diesem Konzentrationsbereich verhält sich Essigsäure wie eine starke Säure).
- Die weiße Kurve ist die erste Ableitung der schwarzen (Skala auf der rechten Seite). Die Theorie sagt voraus, daß schwche Säuren einen Wert von ≈½ und starke einen von ≈1 haben.
- Die gelbe punktierte Kurve ist die Näherungsformel für schwache Säuren. Du siehst, daß sie bis zu Konzentrationen von etwa 10⁻⁴ = 0.0001 mol/l gut funktioniert; bei tiefeen Konzentrationen ist die Essigsäure zu stark dissoziiert (das sieht man an den Hintergrundfarben) und nicht mehr schwach; die Formel versagt also.
- Die orange punktierte Kurve ist die Näherungsformel für starke Säuren; sie funktioniert gut für Konzentrationen unterhalb von 10⁻⁵ mol/l
- Keine der beiden Näherungsformeln kann die Begrenzung des pH auf 7 richtig wiedergeben; für extrem verdünnte Lösungen sagen sie einen pH>7 voraus, was natürlich kompletter Blödsinn ist. Es gibt Formeln, die diesen Fehler nicht machen, aber die sind komplizierter und man lernt sie daher in der Schule eher nicht.
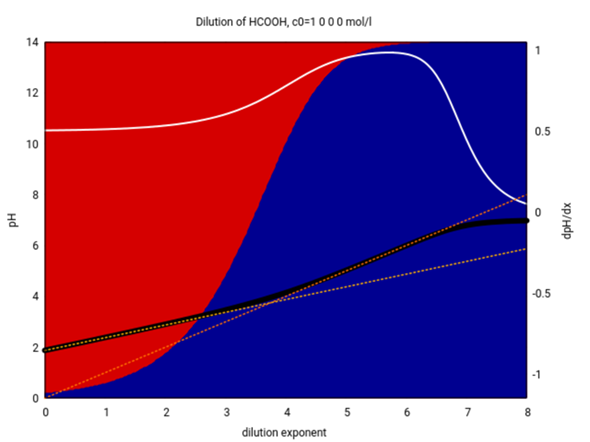
Zum Spaß gibt es hier nochmals dieselbe Graphik für Ameisensäure. Im wesentlichen Zeig sie dieselben Effekte, aber der Übergang vom Verhalten als schwache Säure zum Verhalten als starke Säure liegt bei einer höheren Konzentration, nämlich 0.001 bis 0.0001 mol/l.
Um die richtige Formel zur Berechnung des pH-Wertes auszuwählen, kann man folgendermaßen vorgehen (mit Übung geht es natürlich viel schneller).
- Probiere es zuerst mit der Formel für schwache Säuren, pH=½(pKₐ−lg(c)). Wenn der berechnete pH deutlich kleiner ist als der pKₐ der Säure (und kleiner als 7), dann stimmt das Ergebnis, und Du kannst aufhören.
- Wenn der berechnete pH größer als der pKₐ ist, dann probiere es mit der Formel für starke Säuren, pH=−lg(c). Wenn der damit berechnete pH deutlich größer als der pKₐ ist, aber immer noch kleiner als 7, dann stimmt das Ergebnis, und Du kannst aufhören.
- Wenn Du immer noch kein Resultat hast, dann probiere die allgemeine Formel für intermediäre Säuren, pH=−lg( √(¼Kₐ²+Kₐc) − ½Kₐ ). Wenn das Resultat kleiner als 7 ist, dann stimmt es, und Du kannst aufhören.
- Wenn Du immer noch kein Ergebnis hast, dann liegt Du eine extrem verdünnte Säurelösung mit einem pH von knapp 7 vor. Um den pH genau auszurechnen, brauchst Du bessere Formeln, die auch das Wassergleichgewicht berücksichtigen.
- Wenn Dir das ganze Herumgefummle zu fummelig ist, dann kannst Du auch gleich bei Punkt 3 beginnen und die ersten beiden Versuche weglassen. Die Formel für intermediäre Säuren enthält ja starke und schwache Säuren als Grenzfälle.
Alle Formeln zum Berechnen des pH-Wertes einer wäßrigen Säurelösung sind hier zusammengefaßt; in der ersten Zeile für starke Säuren, in der zweiten für schwache und in der dritten für intermediäre. In der linken Spalte stehen die Formeln, die Du vermutlich kennst und die bei sehr verdünnten Lösungen falsche Resultate (nämlich solche über 7) ergeben; die Formeln in der rechten Spalte haben dieses Problem nicht, sind dafür aber auch ein bißchen komplizierter.

Die Formel im rechten unteren Eck deckt alle Fälle ab und kann blind verwendet werden, ist aber vielen Leuten zu unbequem (und braucht auch numerische Sorgfalt bei der Auswertung). Es gibt auch eine weitere Näherungsformel, nämlich
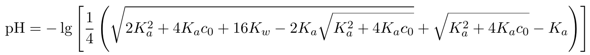
und die funktioniert immer, wenn wenigstens eine der beiden folgenden Bedingungen erfüllt ist: pKₐ ≪ 7 und pH ≪ 7 (dabei ist kleiner 6.5 meistens OK, kleiner 6 völlig unproblematisch). Für pKₐ≫7 ist pH = −½⋅lg [ Kₐc₀+Kw ] übrigens immer gültig.

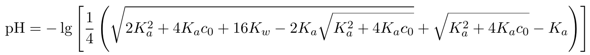

Ich denke für die Schule reicht meine Vereinfachung. Gleichgewichte sind oft noch nicht Thema der SEK 1 oder manchmal auch nur bedingt für die Sek 2. Rechnerisch sollten zu Beginn bei mittelstarken und schwachen Säuren die Unterschiede gering sein


Du kannst "die andere Formel" verwenden, und solange die Lösung hinreichend verdünnt ist stimmt das Ergebnis auch bei einer schwachen Säure. Aber was ist hinreichend?
Ganz einfach: Wenn der berechnete pH-Wert gleich oder kleiner ist als der pKs-Wert, dann gilt die Gleichung für starke Säuren nicht mehr, weil dann ein relevanter Teil der Säure undissoziiert vorliegt.

Ok alles klar, Dankeschön:)
Kannst du mir vllt die meine Frage beantworten?

Schwache Säuren haben einen pKs Wert von ungefähr 4 und aufwärts. Essigsäure gilt als mittelstarke Säure, aber da sollte man beispielsweise schon die Formel nutzen, die Du angegeben hast

Ah. Also muss ich den pks wert berechnen, also den negativ dekadischen Logarithmus von H3O+ Ionen. Und wenn es den Wert mehr als 4 hat, dann muss ich das in die angegebene Formel einsetzten, um den PH Wert zu ermitteln?