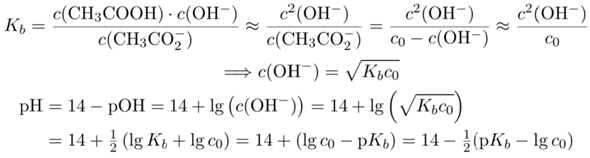pH = 14- 1/2 (pKb− log (c0(S))?
Diese Formel sollen wir zur Berechnung des pH-Wertes am Äquivalenzpunkt der Titration einer schwachen Säure mit einer starken Base benutzen. Der pKb-Wert bezieht sich nicht auf den der Base der Maßlösung, sondern auf den den der korrespondierenden Säure der Probelösung. Aber wie kommt die zustande? Die anderen kann man sich alle einfach herleiten, die verstehe ich nicht 🥹…
1 Antwort
Wenn Du z.B. eine Essigsäure (oder eine andere schwache Säure) mit einer starken Base (NaOH) titrierst, dann bekommst Du am Äquivalenzpunkt eine Lösung des Salzes, im Beispielfall also Natriumacetat. Welchen pH hat das?
Der den pH bestimmende Bestandteil ist das Acetat-Ion, weil das eine sehr schwache Base ist. Ein winziger Anteil des Acetats reagiert mit dem Wasser nach
CH₃CO₂⁻ + H₂O ⟶ CH₃COOH + OH⁻
also reagiert die Suppe schwach basisch. Das funktioniert nur, weil Essigsäure selbst schwach ist und deshalb in sehr kleinen Mengen neben OH⁻ existieren kann, ohne daß Neutralisation eintritt. Mit einer starken Säure wie HCl könnte das nicht passieren, deshalb hat man bei einer Titration HCl/NaOH am Äquivalenzpunkt pH=7.
Wenn Du jetzt den pH am Äquivalenzpunkt berechnen willst, dann mußt Du das Massenwirkungsgesetz für die Basenreaktion aufschreiben und bekommst mit ein paar Näherungen die von Dir genannte Formel heraus.

Dabei haben wir in der ersten Zeile zwei Näherungen eingeführt, nämlich c(OH⁻)=c(CH₃COOH) weil beide 1:1 durch die obige Protolysegleichung entstehen, und c(CH₃CO₂⁻)=c₀ weil nur sehr wenig Acetat überhaupt reagiert. Dann geht es nur noch um simples Einsetzen, pOH=−lg(c(OH⁻)) und ein paar Umformungen mit den Logarithmen, u.a. lg(ab)=lg(a)+lg(b) und pK=−lg(K).
Beachte aber daß in dieser Gleichung c₀ die Konzentration des Acetats am Äquivalenzpunkt ist; das ist nicht dasselbe wie die Konzentration der Essigsäure in der Probe, weil während der Titration ja noch Maßlösung dazukommt und daher Verdünnung eintritt.