Mesomere Grenstrukturen beim σ-Komplex?
"Bindung, Bindung, du musst wandern. Von dem einen Kohlenstoff-Atom vom anderen. Das ist schön, das ist schön, jeder kann die Bindung sehen."
Tja, anscheinend jeder außer icke. Denn bei folgender Aufgabe hab ich gerad 'nen Hänger:
"Zeichnen Sie alle mesomre Grenzstrukturen des intermediären σ-Kompexes bei der Bromierung von ANisol (Methoxybenzol) mit Brom in para-Stellung"
Ich hab jetzt im Internetz gelernt, dass man eine Bindung einmal durch den ganzen Ring wandern lassen soll und dann schaut, welche Konstellationen funktionieren. (Es darf ja keine 2 Doppelbindungen hintereinander geben usw).
Hier in der Lösung wird jetzt ein ganz anderer Approach verwendet, nämlein daß immer geguckt wird, wo ein Elektronenmangel ist und dann die Doppelbindung dorthinschiebt. Schön und gut, aber woher weiß man dann, wenn man fertig ist. Ich sehe gerade keine andere Lösung als den linke Bindung oben einmal komplett durchlaufen zu lassen und zu gucken, wo sie andocken darf.
Dabei ist mir eine neue Kombination eingefallen
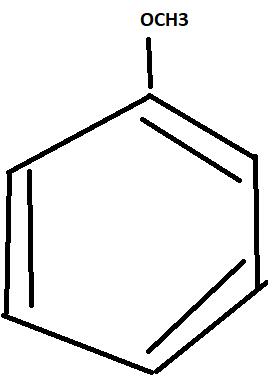
Warum ist die Kombination nicht legitim?
(Kleine Randnotiz: Falls jemand eine Seite kennt auf der man Ringe zeichnen kann...immer her damit. Meine Ringe auf Microsoft-Paint sehen so kacke aus^^)
Desweiterene erscheint mir die folgende Lösung etwas sus:
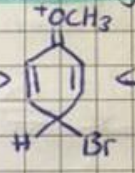
"sus" ist Jugendsprech' und heißt wohl, wenn etwas komisch aussieht (vom englischen "suspective" = "verdächtig"). Wenn jetzt hier bei dem OCH3 oben ein Elektronenmangel ist, kann man den ja gar nicht er ausgleichen durch Verschieben von irgendwelchen Bindungen. Wie ist das zu verstehen
Mit freundlichen Grüßen,
Hans Sarpei
3 Antworten
Moin,
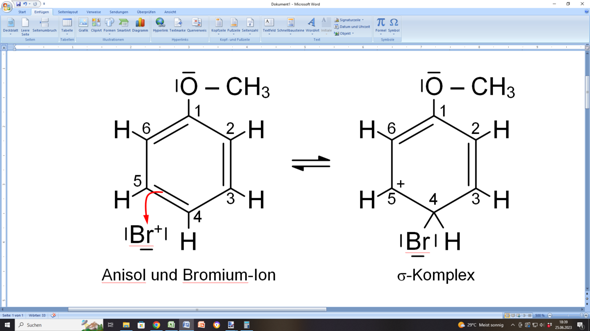
beim Zeichnen von mesomeren Grenzstrukturen gehst du schrittweise vor. Alles beginnt ja mit dem elektrophilen Angriff eines Bromium-Ions auf das aromatische Ringsystem des Anisols:
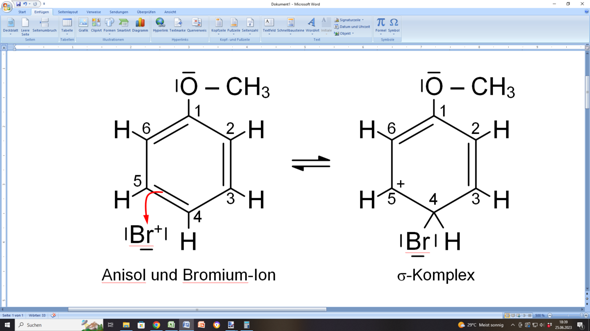
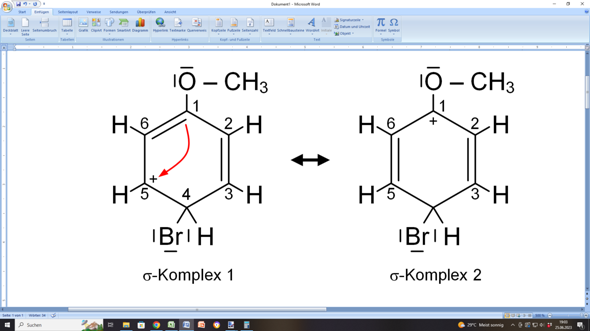
Das kannst du dir so vorstellen, als würde die C=C-Doppelbindung zwischen C4 und C5 nach außen zum Bromium-Ion „umschlagen”, wodurch das Bromium-Ion als Bromsubstituent über eine Einfachbindung an C4 gebunden wird.
Dadurch entsteht allerdings an C5 eine Elektronenlücke, weil dieses Kohlenstoffatom nur noch dreibindig ist. Deshalb trägt jetzt dieses C-Atom eine positive Ladung, die ursprünglich das Bromium-Ion mitgebracht hatte.
Dieser „ungemütliche” Zustand wird sofort behoben, indem nun die C=C-Doppelbindung zwischen C1 und C6 von C6 nach C5 „umklappt”:
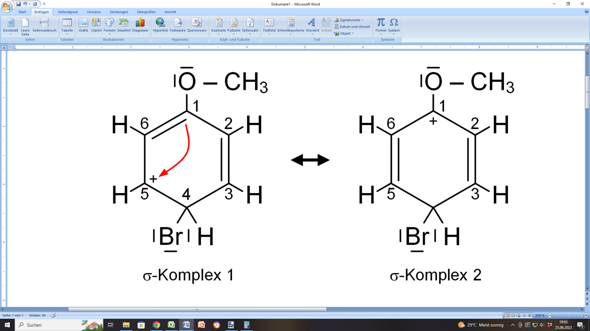
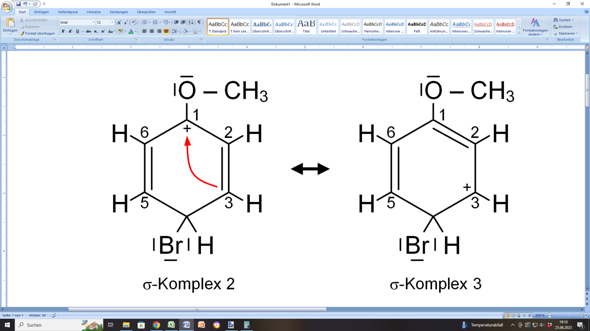
Natürlich hat nun C1 nur noch drei Bindungen und ist deshalb positiv geladen. C1 kann aber auf zweierlei Weisen unterstützt werden: Entweder die C=C-Doppelbindung zwischen C2 und C3 „klappt” von C2 nach C1 „um”:
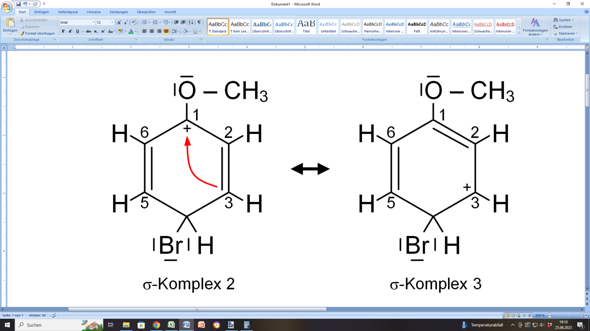
Dann wandert die positive Ladung nach C3, weil dieses Kohlenstoffatom nur noch dreibindig wäre.
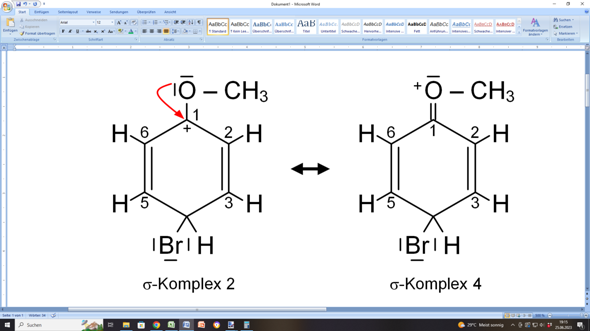
Oder der Substituent (in diesem Fall das Sauerstoffatom der Methoxygruppe) hilft aus:
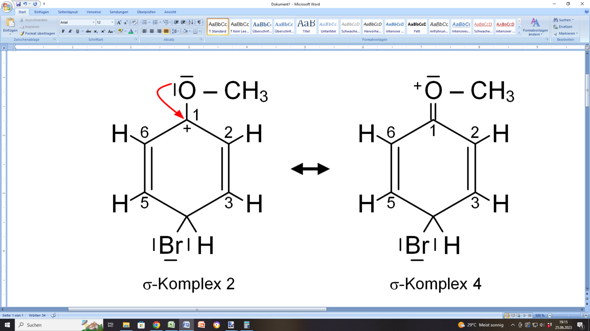
Das geht, weil das Sauerstoffatom über zwei freie, nicht-bindende Elektronenpaare verfügt. Eines davon kann es also dem Ring zur Verfügung stellen. Das bezeichnet man als +M-Effekt, weil damit die Mesomerie des Rings gefördert wird.
Freilich ist der Anteil dieser Form der Unterstützung verhältnismäßig gering, weil Sauerstoff sehr elektronenaffin ist und deshalb nicht gerne eine positive Formalladung trägt.
Aber denke nur mal an das Oxonium-Ion (H3O+), das entsteht, wenn sich Säuren in Wasser lösen. Dort ist auch das Sauerstoffatom durch den Eintritt des Protons ins Wassermolekül formal positiv geladen. Das geht also.
Mit anderen Worten: Du kannst für den sigma-Komplex vier verschiedene mesomere Grenzstrukturen aufstellen. In dreien davon trägt ein Kohlenstoffatom des Rings die positive Ladung (C5, C1 oder C3) und einmal das Sauerstoffatom der Methoxygruppe.
Die Grenzstrukturen sind Hilfskonstruktionen, damit in der Chemie erklärt werden kann, weshalb bestimmte Reaktionen ablaufen.
Die Realität ist das nicht. Ich finde dazu immer die Geschichte mit den mittelalterlichen Fabelwesen und dem realen Tier sehr schön: Die Realität ist das Nashorn. Die Grenzstrukturen sind die nicht existierenden Fabelwesen Einhorn und Drachen (das Nashorn als Mischung aus Einhorn und Drachen)...
Dir kommt die Grenzstruktur mit der positiven Ladung am Sauerstoff suspekt vor. Zu Recht, weil der Sauerstoff nicht gerne positiv geladen ist, weil er Elektronen liebt. Aber darum geht es hier nicht. Es ist möglich, also trägt diese Grenzstruktur zur Mesomerie bei (wenn auch meinetwegen prozentual weniger als die anderen drei Grenzstrukturen.
Je mehr Grenzstrukturen du formulieren kannst, umso größer ist die Mesomerie und umso stabiler ist der Zwischenzustand.
LG von der Waterkant
Das ist nicht verboten. Ohne Substituenteneingang hast du ein aromatisches System. Da sind die Doppelbindungen über alle sechs Kohlenstoffatome verteilt.
Mit dem Eintritt des Elektrophils wird die Aromatizität gestört.
Theoretisch könnte das Elektrophil an C4 oder C5 (C3) gebunden werden. Aber wenn es an C3 oder C5 gebunden werden würde, könntest du für den sigma-Komplex nur drei Grenzstrukturen zeichnen (mit Plusladungen an C4, C2 oder C6). Das ist eine Grenzstruktur weniger als bei einer Bindung an C4 (oder C2 / C6). Und wie ich schon sagte: Je mehr Grenzstrukturen, desto stabiler der Übergangszustand.
Wie genau meinst du das mit C4 oder C5 (C3)? Ich meinte jetzt nicht das Elektrophil (also Br), sondern ob die Doppelbindung von C5 nach C6 (und gleichzeit von C1 nach C2 und C3 und C4) erlaubt wär. ir ist gerade deine Notation nicht so ganz klar. Meinst du mit "Grenzstrukturen", das immer eine Plusladung dranhängen muss?
Nein, wie gesagt: Ohne aufgenommenes Elektrophil ist es ein aromatisches System. Dann gibt es zwei Grenzstrukturen, nämlich einmal eine mit Doppelbindungen zwischen C1 und C2, C3 und C4 sowie C5 und C6 UND eine mit den Doppelbindungen zwischen C2 und C3, C4 und C5 sowie C6 und C1.
Die Doppelbindungen „zirkulieren” im Ring (oder besser gesagt, es ist völlig unklar, wo sie sich befinden, denn die beiden formulierbaren Strukturen sind ja bloß Grenzstrukturen, die es in der Realität so nicht gibt.
Das drückt mein erster Abschnitt auf deine Nachfrage aus.
Aromaten zeichnen sich durch delokalisierte pi-Elektronen aus. Das heißt, dass diese Elektronen an keinen festen Platz gebunden sind.
Das stabilisiert das Molekül.
Wenn nun aber ein Elektrophil den aromatischen Ring angreift, dann wird diese aromatische Stabilität vorübergehend gestört und es entsteht der sigma-Komplex. Am Ende trennt sich diese Zwischenstufe dann von einem Proton (H+) und regeneriert das aromatische System (gerade weil das so stabil ist).
Das ist ja dann auch der Grund, warum die elektrophile Substitution die bevorzugte Reaktion von Aromaten ist (und nicht die elektrophile Addition, die sonst viel typischer für ungesättigte Kohlenwasserstoffe ist).
Die von dir gezeichnete „neue Kombination” ist also legitim und stellt eine der beiden Grenzstrukturen des aromatischen Systems dar.
Ich hoffe, dass es jetzt klarer geworden ist...
Danke erstmal für diese ausführliche Antwort. Kann ich mir also merken, daß ich beim Sigma-Komplex nicht , wie von mir eingangs vermutet, die Bindung einmal komplett durch den Ring wandern lassen muss, sondern einfach immer nur gucken muss, wo Elektronenmangel ist und dann die Bindung dort umklappen lasse?. Weil immer wenn Elektronen-Mangel ist und man es umklappt, spricht man vom Sigma-Komplex, ne c'est pas?
Ja, so kannst du es ausdrücken. Und ohne Elektronenmangel (aromatisches System) „klappen” immer alle drei Doppelbindungen „um” und zirkulieren so im Ring... Deshalb stellt man ein aromatisches System oft auch als Sechseck mit einem Kreis darin dar.
Was die Anzahl der sigma-Komplexe angeht, musst du schauen, dass die positive Ladung möglichst oft im Ring ODER in den Substituenten auftaucht.
Keine Sorge, mit der Zeit wirst du immer besser darin werden, das alles zu sehen und dann auch die Grenzstrukturen formulieren zu können.
Viel Spaß beim Entdecken der faszinierenden Welt der Aromaten...
Ich empfehle dir: molview.org
Es spuckt dir CAS-Nummern, IUPAC-Namen, natürlich 2D/3D-Grafiken usw. aus. Das naheliegendste Programm ist ChemDraw oder ChemSketch. Lizenzen solltest du über die Universität bekommen, informiere dich bei Kommilitonen, älteren Studierenden oder im Rechenzentrum.
In Wirklichkeit sind diese mesomeren Formeln die einfachste (und ungenauste) Annäherung an das, was die Numerik auf verschiedene Weisen behandelt. Elektronendichte. Das, was du zeichnest, heißt Whealand-Komplex.
Ich sehe keinen Grund, warum die Partialladung am Sauerstoff verboten sein söllte. Sie ist nur unwahrscheinlicher, weil Sauerstoff die höchste EN hat.
Man kann sagen: die Grenzformel mit den häufigsten und stabilsten Partialladungen entspricht der Dichteverteilung. Die Formeln darfst du für unten selbst aufmalen:
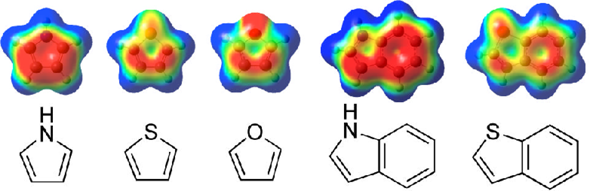
Leider habe ich kein passendes Bild gefunden. Daher ein Beispiel gängiger Heteroaromaten. (Quelle: Lin, Herbert et al. - Dipalladium(I) terphenyl diphosphine complexes as models for two-site adsorption and activation of organic molecules, JACS 10/2013, DOI:10.1021/ja406696k)
Danke für den hilfreichen Link.
Nur eine Frage noch: Die darstellung die ich jetzt gezeichnet hab, taucht im Whelaand-Komplex gar nicht auf: https://en.wikipedia.org/wiki/Electrophilic_aromatic_substitution#/media/File:Electrophilic_aromatic_substitution.svg ?
Nicht alles, was Wikipedia sagt, ist korrekt. Für Mesomerie gibt es meinem Wissen nach keine offiziellen Regeln.
Grundsätzlich hast Du recht: In einem σ-Komplex gibt es genau ein vierbindiges Atom, und in o- oder p-Stellung dazu die positive Ladung. Dazu kommen dann gegebenenfalls noch Möglichkeiten, die Ladung auf die Substituenten zu schieben; dazu braucht man +M-Substituenten (also solche mit einsamem Elektronenpaar) in o,p-Stellung. Das ist übrigens genau der Grund, weshalb solche Substituenten o,p-dirigierend wirken, denn die zusätzliche Grenzstruktur stabilisiert den σ-Komplex, und für Angriff in m-Position läßt sich keine entsprechende Grenzstruktur finden.
Was Du mir mit der Anisol-Strukturformel sagen willst, kann ich nicht erraten.
Danke für die antwort. meine Frage war, ob die Zeichnung, die ich per Paint eingefügt habe, ebenfalls eine korrekte Grenzstuktur wäre
Aber die Zeichnung zeigt doch nur Anisol, keinen σ-Komplex. Da müßte ja noch ein Br⁺ dranhängen.
Danke für die ausführliche Antwort, inklusive Graphiken.Meine Frage bezog sich auf die von mir gezeigte Graphik. Warum ist die nicht erlaubt? Also warum kann ich eine Doppelbindung zwischen 5 und 6, eine Doppelbindung zwischen 1 und 2 und eine Doppelbindung zwischen 3 und 4 haben. Wieso ist das verboten?
Bzw. wann genau weißt du dass du wirklich alle Kombinationen durchgespielt hast?