Hin und Rückreaktion im endothermen Diagramm?
Das rächt sich gerad' so, dass ich "Experimentalphysik 1" letztes Jahr geschoben hab. Denn während meine Kommilitonen sich bereits seit 3 Wochen auf die "Chemie 1"-Klausur vorbereiten, bleibt mir jetzt nur noch die eine Woche (da ich heute noch Ex-Klausur hatte). Da es schnell gehen muss und derzeit jede Sekunde pures Gold ist, verzichte ich auf eine lange Vorleitung und komme direkt zum Punkt. (ok, irgendwie war's dann doch wieder ne lange Einleitung😄)
"Zeichne das Reaktionsdiagramm für
a)eine exotherme Reaktion mit und ohne Katalysator
Stupides Googeln, bzw Allgemeinbildung
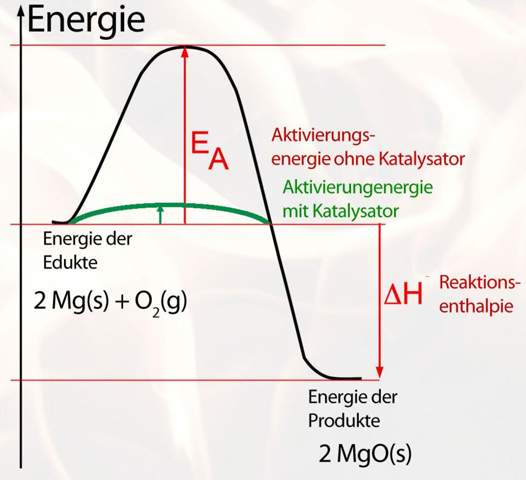
(Bildquelle: https://www.u-helmich.de/bio/stoffwechsel/reihe2/Bilder/energiediagrammMgKat.jpg)
b) eine endotherme Reaktion. Zeichne in deiner SKizze die Aktivierungsenergie für die Hin- und Rückreaktion."
Ansatz:
endotherme Reaktion
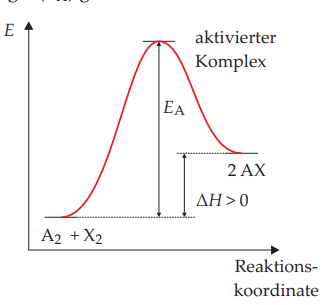
Jetzt bin ich hier nicht sicher wie ich das der Aktivierungsenergie für die Hin- und Rückreaktion in die Skizze einbringen soll. Ist die Hinreaktion "A2 + X2" und die Rückreaktion "2AX". oder muss ich da noch irgendwas mitreinzeichnen?
Ich weiß dass eine endotherme Reaktion nach dem Motto abläuft, dass die Reaktanden "A-B+C" zu "C-AB" reagieren, also dass quasi die Bindung zwischen A-B aufgebrochen wird und das A zum C gezogen wird. Aber wie soll ich das jetzt graphisch darstellen?
Also es geht mir eigentlich um den Punkt der Aktivierungsnergie für Hin und Rückreaktion.
ich bitte um Verzeihung, wenn es wieder so eine Frage ist, die sich durch stupides Googeln beantworten lässt. Aber ich find da gerad' den Wald vor lauter Bäumen bzw. die Hin/Rückreaktion vor lauter Diagrammen nicht.
Liebe Grüße,
Jensek81
2 Antworten

Hi!
Jetzt bin ich hier nicht sicher wie ich das der Aktivierungsenergie für die Hin- und Rückreaktion in die Skizze einbringen soll. Ist die Hinreaktion "A2 + X2" und die Rückreaktion "2AX". oder muss ich da noch irgendwas mitreinzeichnen?
Nö, eigentlich nicht. Das Energiediagramm der Hinreaktion kannst du spiegeln und hast dann das Energiediagramm der Rückreaktion.
Zur Aktivierungsenergie selbst: Bei einer exothermen Hinreaktion ist die Rückreaktion endotherm und umgekehrt. Das heißt: Bei der exothermen Hinreaktion ist die Aktivierungsenergie die Energie von der Eduktenergie bis zum Hochpunkt der Energiekurve (= Übergangszustand). Bei der Rückreaktion ist die Aktivierungsenergie der gesamte Berg bis zum Hochpunkt der Reaktion.
Du musst quasi die Differenz von Produkt- und Eduktenergie, die du bei der exothermen Hinreaktion herausbekommst, bei der Rückreaktion zusätzlich mit investieren an Aktivierungsenergie.
Ich weiß dass eine endotherme Reaktion nach dem Motto abläuft, dass die Reaktanden "A-B+C" zu "C-AB" reagieren, also dass quasi die Bindung zwischen A-B aufgebrochen wird und das A zum C gezogen wird. Aber wie soll ich das jetzt graphisch darstellen?
Das verwirrt mich ein bisschen, was du damit aussagen willst. Du könntest an die Stellen der Reaktion die entsprechenden Moleküle zeichnen. Da du dich aber vor allem auf die Aktivierungsenergie beziehst, könntest du das vielleicht wie folgt einzeichnen:
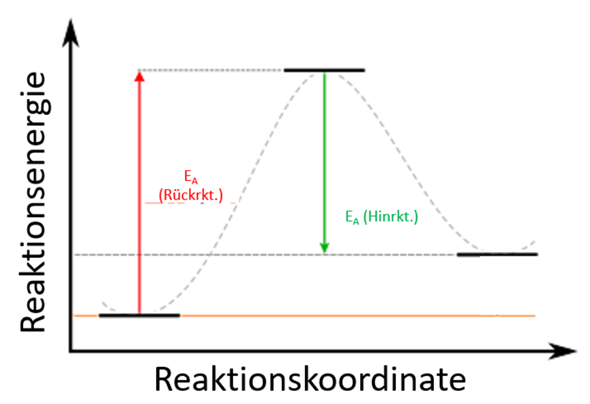
Was Besseres, als das so zu verdeutlichen (oder zwei Graphen in eine Grafik zu packen), fiele mir jetzt auch nicht ein.
LG
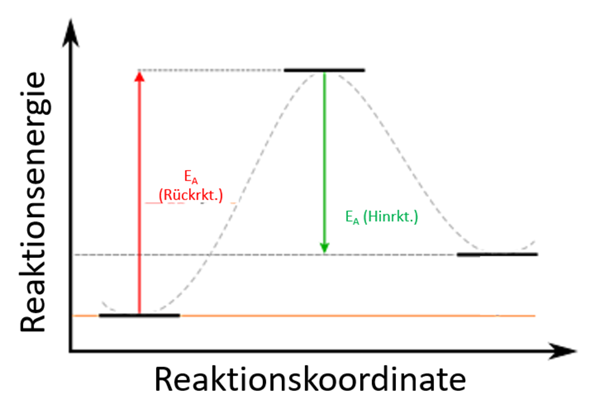

Ich glaub, du zerdenkst dir das alles grade. Die Rückreaktion einer exothermen Reaktion ist endotherm. Du musst den oberen Graphen einfach nur "umdrehen".
Die Aktivierungsenergie ist immer der Abstand der "Energie der Edukte" und der "Energie des Übergangszustands". Wie das bei einer endothermen Reaktion dann aussieht, sieht man ja im zweiten Bild. Wenn da jetzt noch ein Katalysator mit rein kommt, wird der Berg halt einfach nur kleiner.

Danke für die Antwort.
Ich bin mir jetzt nur nicht sicher, wie ich jetzt in der Skizze zu b) die geforderte "Aktivierungsenergie für die Hin- und Rückreaktion" mi teinzeichnen soll. Weil wenn ich das richtig versteh ist die endotherme Hinreaktion ja die exotherme Rückreaktion.
Also ich weiß jetzt nicht, wie ich die Aktivierungsenergie für die Hin und Rückreaktion hinzeichen soll. Ich hab jetzt einfach einen Pfeil mit "EA" vom Ausgang der Reaktion bis zum Scheitelpunkt der Kurve gemacht. Aber das ist ja nur ein Pfeil. Das wird denen wahrscheinlich nicht reichen.