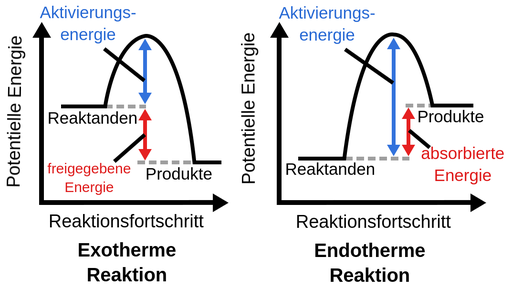
Exotherme und Endotherme Reaktionen?
Hallo, ich habe eine Frage :) Und zwar heißt es ja, dass bei der exothermen Reaktion man eine Aktivierungsenergie braucht, dass eine Reaktion stattfindet. Und bei der endothermen Reaktion braucht man auch eine Aktivierungsenergie. Müsste dann aber auch bei der endothermen eine ganz geringe Menge an Energie freiwerden?
Oder 0% (keine)? Ich wäre sehr dankbar für eine Antwort.
3 Antworten
Also der Unterschied zwischen endo- und exothermer Reaktion liegt in ihrer "Nettoenergie", also der Differenz zwischen Altivierungsenergie und Reaktionsenergie. In beiden Fällen wird eine Aktivierungsenergie gebraucht, um die Reaktion in Gang zu bringen. Bei der Bildung des Produkts wird auch in beiden Fällen (!) wieder Energie frei (Reaktionsenergie). Nur entscheidend ist jetzt, wie viel.
Bei einer exothermen Reaktion ist die aufzuwendende Aktivierungsenergie (EA) kleiner als die frei werdende Reaktionsenergie (ER). Für die Gesamtenergie gilt also: E = ER - EA > 0. Das E größer als 0 ist, setzt die Reaktion also Energie frei.
Bei einer endothermen Reaktion ist es genau anders herum. Die Aktivierungsenergie ist größer als die Reaktionsenergie. Und damit ist die Gesamtenergie E = ER - EA < 0. Das heißt also der Reaktion muss kontinuierlich Energie von außen zugeführt werden.
Exotherme Reaktionen setzen ganz viel Energie frei und Endotherme brauchen eine bestimmte Menge an Aktivierungsenergie um stattfinden zu können und setzen keine Energie frei.
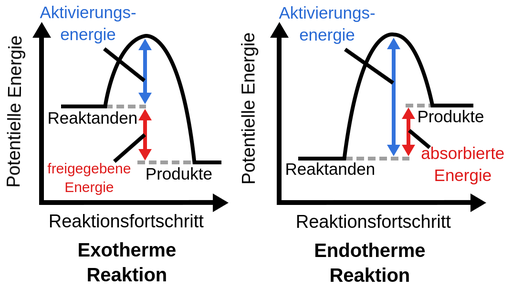
Das Schaubild zeigt das ganz gut. Die endotherme Reaktion als Ganzes betrachtet nimmt somit nur Energie auf, da die potentielle Energie der Produkte höher ist als die der Edukte.