Oxidationszahlen Tetrasauerstoffdiflourid?
Heeeiiii Leeeeeuuuuutee
Die Oxidationszahlen beim oben genannten Molekül sind F: -l und O: +0,5 , richtig?
Aber wie soll ich das wissen wenn ich nicht googeln kann?
Die OZs müssen ja nicht bei jedem Atom eines Elements in einem Molekül gleich sein wie Ethanal zeigt:
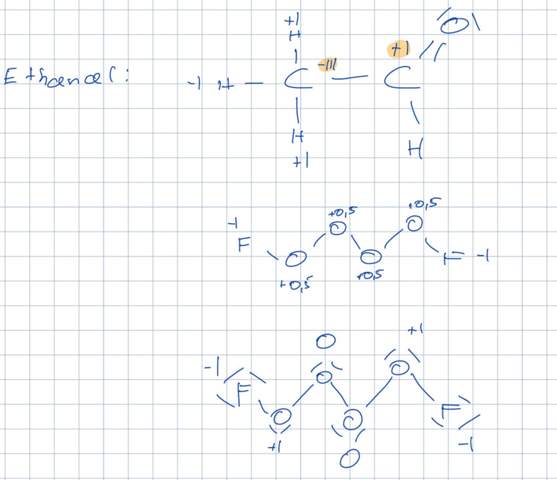
Woher weiß ich also ob das obere Tetrasauerstoffdiflourid oder das untere von den OZs her stimmt?
1 Antwort

F—O⁺ᴵ—O⁰—O⁰—O⁺ᴵ—F
Die mittleren Sauerstoffatome haben also die Oxidationszahl 0, die an Fluor gebundenen die Oxidationszahl +I. Das siehst Du an Deiner Lewis-Formel ganz unten; Du mußt ja nur die Elektronen nach Elektronegativität zuteilen und abzählen.
Natürlich kann man auch einfach sagen, das Fluor wird −I haben, und zur Elektroneutralität haben die Sauerstoffe im Mittel +½. Aber das ist natürlich weniger genau.
Im analogen H₂O₄ ist es übrigens ähnlich, denn da hat der Wasserstoff +I, die daran gebundenen O-Atome dann −I und die mittleren wieder 0.