Können endotherme Reaktionen auch exergon sein?
Hallo! Ich bräuchte diese Frage erklärt. Meines Wissens kann auch eine endotherm Reaktion exergon sein wenn zb nach DeltaG = DeltaH - T*Delta S der Term T*DeltaS hoch genug ist.
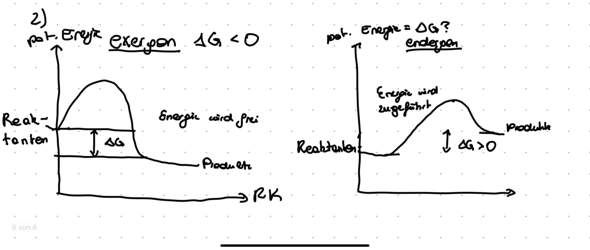
Mir wurde aber gesagt, dass eine exergone Reaktion exotherm ist. Diesem Diagramm zufolge müsste das auch so sein, da man hier einmal links eine exergone Reaktion sieht, die den gleichen Verlauf besitzt wie eine exotherm Funktion und vice versa.
Was stimmt nun?
Danke im Vorraus!
3 Antworten
So wirklich sehe ich bei Deiner Frage nicht durch. Die Titelfrage ist Unsinn (kann man gleichzeitig gewinnen und verlieren? Nein, zumindest nicht auf derselben Skala), und bei den gekritzelten Reaktionsprofilen ist mir nicht klar, ob sie sich auf dieselbe Reaktion beziehen oder nicht.
Also das Offensichtliche:
- Eine Reaktion ist exotherm, wenn ΔH<0, und endotherm wenn ΔH>0. Beides gleichzeitig geht nicht.
- Eine Reaktion ist exergon, wenn ΔG<0, und endergon wenn ΔG>0. Beides gleichzeitig geht nicht.
- Da ΔG=ΔH−T⋅ΔT, können sich ΔG und ΔH im Vorzeichen unterscheiden. In der Praxis kommt das eher selten vor, da das Produkt T⋅ΔS meist zu klein ist (genauer: |T⋅ΔS| < |ΔH|) und daher gegen den ΔH-Term nur schlecht anstinken kann. Das gilt bei Raumtemperatur, bei höheren Temperaturen sieht es anders aus, weil der Betrag von T⋅ΔS mit der Temperatur natürlich ansteigt.
- Das Lehrbuchbeispiel für eine Reaktion mit ΔH>0 (endotherm) und ΔG<0 (exergon) ist der Zerfall von N₂O₅; er tritt bei Raumtemperatur spontan (mitunter sogar explosiv) ein, obwohl die Reaktion moderat Energie verbraucht. Die Bildung vieler gasförmiger Reaktionsprodukte aus einem kristallinen Festkörper bewirkt einen atypisch hohen Entropiegewinn, der ausreicht, daß ΔG=ΔH−T⋅ΔS negativ wird.
Also ist in beiden Zeichnungen ΔG aufgetragen? Naja, manche Reaktionen sind endergon andere exergon. Aber eine kann nicht beides sein. Also zeigen die beiden Graphiken verschiedene Reaktionen.
Alternativ kann man natürlich auch ΔH auftragen, und das sieht dann mehr oder minder gleich aus — wenn Du jedes G durch ein H ersetzt, dann ist die linke Reaktion exotherm und die rechte endotherm.
Danke! Ja das mein ich. Meine Frage wäre jetzt nur wieso die exergonische Reaktion aussieht wie eine exotherme wenn exergonische Reaktionen doch auch endotherm sein können?
Das Reaktionsprofil mit ΔH ist etwas anderes als das mit ΔG. Wenn Du nur eines davon kennst, kannst Du nicht voraussagen, wie das andere für dieselbe Reaktion aussehen wird.
Nehmen wir an, Du hast vier Graphiken gegen — zwei mit ΔG (eine exergon, die andere endergon), und zwei mit ΔH (eine exotherm, die andere endotherm). Du kannst nicht entscheiden, welche dieser Graphiken zur selben Reaktion gehören. Wenn das ganze bei Raumtemperatur oder darunter stattfindet, dann liegt es nahe, zu vermuten, daß die endergone Reaktion auch endotherm ist (und die exergone auch exotherm). Das wird in der Mehrzahl der Fälle stimmen, aber wie das N₂O₅-Beispiel oben zeigt, nicht immer. Und je höher die Temperatur wird, umso mehr sinkt die Trefferquote — bei Raumtemperatur ist ΔG tendenziell von ΔH dominiert, aber bei T>1500 °C dominiert das ΔS.
Die Titelfrage ist falsch von autokorrekt. Das sollte eigentlich heißen: können endotherme Reaktionen auch exergon sein. Hab schon einen Bearbeitungsvorschlag abgeschickt aber es glitscht andauern haha.
eine endotherme Reaktion kann oberhalb einer bestimmten Temperatur exergonisch sein, wenn die Änderung der Enthalpie negativ ist. Hier sind ein paar schöne Erklärungen.
https://www.sofatutor.com/chemie/videos/exergone-und-endergone-reaktionen
Die Berechnung dieser Grenztemperatur ist eine beliebte Abi Aufgabe.
m.f.G.
anwesende
So, habe mich kundig gemacht 😉 Hier ist, wenn ich das richtig sehe, Delta G auch korrekt eingezeichnet. Da eine exergone Reaktion per Definition Energie an die Umgebung abgibt, die endotherme sie aber aufnimmt, so dass abschließend Delta G positiv oder eben negativ ist, kann es nur das eine oder andere sein 🙂
Die Titelfrage ist von der autokorrektur falsch verbessert worden. Das sollte eigentlich heißen: können endotherme Reaktionen auch exergon sein. Das war meine Frage vorher an dich :)
Die Autokorrektur auf dieser Seite ist aber manchmal auch anstrengend 😉
Danke für deine Antwort! Bei dem "Gekritzel" handelt es sich einmal um eine exergone und einmal um eine endergonische Reaktion. Meine Frage wäre wie folgt: wieso sieht die exergonische Reaktion aus wie eine exotherme Reaktion wenn doch aber exergonsiche Reaktionen auch endotherm sein können