Chemie: Was passiert im Pufferbereich?
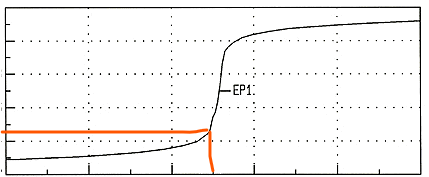
Wieso steigt hier der pH-Wert erst so langsam und plötzlich dann so sehr? Liegt es daran -wenn wir jetzt Essigsäure Teilchen nehmen würden- dass die Acetat Ionen dann mit den Oxonium Ionen reagieren?
2 Antworten

Bei Deiner Graphik scheint es sich um die Titration einer starken Säure, z.B. HCl, mit NaOH zu handeln.
Nimm an, Du hast am Anfang 100 ml einer 0.1 mol/l HCl (pH=1) im Kolben, und Du titrierst mit einer 0.1 mol/l NaOH. Dann liegt der Äquivalenzpunkt offenbar bei 100 ml, und die gesamte Stoffmenge HCl am Anfang der Titration beträgt cV=10 mmol.
- Nach 10 ml Verbrauch hast Du n=cV=1 mmol NaOH zugegeben, die frißt ebensoviel HCl. Es verbleiben 9 mmol HCl in 110 ml Suppe ⇒ c=n/V=0.082 mol/l und daher pH=−lg(c)=1.09. Es hat sich also noch nicht viel getan.
- Nach 50 ml Verbrauch ebenso: es sind noch 5 mmol HCl in 150 ml Suppe ⇒ pH=1.48, immer noch keine große Änderung.
- Nach 90 ml Verbrauch: 1 mmol HCl in 190 ml ⇒ pH=2.28, man sieht endlich etwas, aber das ist immer noch keine dramatische Änderung.
- Nach 99 ml Verbrauch ⇒ pH=3.30, jetzt tut sich langsam etwas.
- Nach 100 ml Verbrauch muß der pH aber 7 sein, weil die Neutralisation komplett ist.
- Also springt der pH von V=0 bis V=99 ml um läppische 2.3 Einheiten, aber der nächste Milliliter bringt satte 3.7 Einheiten. Die Kurve ist also anfangs flach und wird am Äquivalenzpunkt sehr steil.
Man kann übrigens eine Einfache Formel für den pH in Abhängigkeit vom Verbrauch V angeben. Dabei sind c,V die Konzentration der NaOH-Maßlösung bzw. der Verbraucht, und c₀,V₀ sind Konzentration und Volumen der HCl am Anfang der Titration:
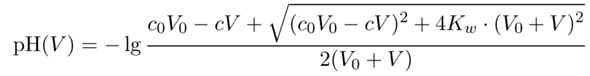
Diese Formel funktioniert vor, nach und auch knapp am Äquivalenzpunkt.
P.S.: Du schreibst in Deiner Frage von einem Pufferbereich. Aber Deine Titrationskurve zeigt die Titration einer starken Säure mit NaOH, und daher hat sie keinen Pufferbereich. Ein solcher kann nur auftreten, wenn man schwache Säuren mit NaOH titriert.
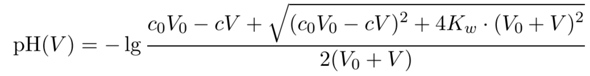

Ich verstehe Dich nicht. Deine Titrationskurve hat nichts mit Essigsäure zu tun. Die Titrationskurve von Essigsäure (oder einen anderen schwachen Säure) mit NaOH würde anders aussehen:
- Am Anfang sieht man einen ziemlich steilen Anstieg
- In der Mitte gibt es einen Pufferbereich, bei dem der pH ungefähr dem pKₐ der Säure (bei Essigsäure ≈4.8) entspricht
- Am Äquivalenzpunkt liegt der pH im Alkalischen, also oberhalb von 7.
Nichts davon ist in Deiner Graphik zu sehen.
Und ja, bei einer solchen Titration käme der Pufferbereich dadurch zustande, daß die neu dazugekommene NaOH mit der Essigsäure zu Natriumacetat reagiert und daher nicht direkt den pH absenkt (es reagiert nicht mit dem H₃O⁺). Indirekt wirkt das zwar ein bißchen auf den pH zurück, aber nur wenig, und deshalb steigt die Kurve nur sehr langsam an.

nein, das ist einfach ein mathematischer/graphischer Effekt, der sich durch die logarithmische Natur des pH-Wertes ergibt.
m.f.G.
anwesende
PS: Deine Frage ist falsch und müsste lauten: Was passiert am Äquivalenzpunkt
Was passiert da denn auf Teilchenebene, dass bis 99ml sich die Konzentration kaum ändert. Bei 100ml folgt ja: n(NaOH) = n(Essigsäure). Reagieren die NaOH Teilchen zu Beginn nicht sofort, so dass die Flüßigkeit nicht stark alkalischer wird?