Titrationsaufgabe mit Citronensäure?
Kann vielleicht einer weiterhelfen wie man hier vorgehen muss??

.
1 Antwort
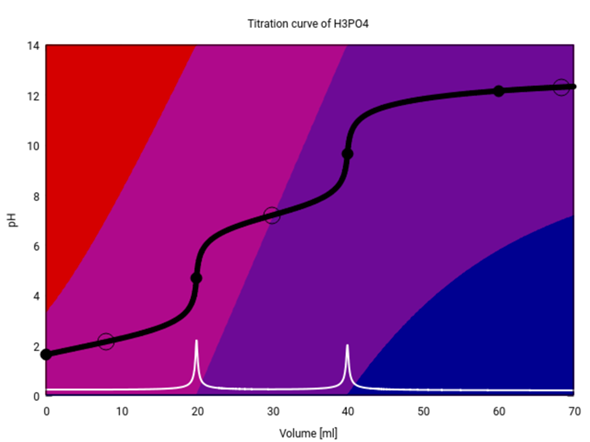
Das ist die Titrationskurve von H₃PO₄ (20 ml 0.1 mol/l H₃PO₄ mit 0.1 mol/l NaOH)
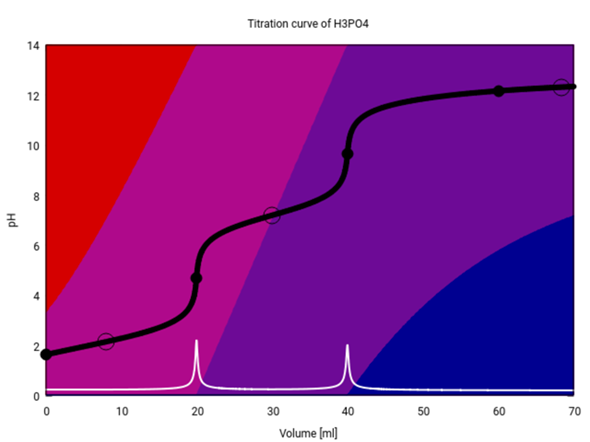
Dabei ist die Titrationskurve schwarz und ihre erste Ableitung weiß eingezeichnet . Die Hintergrundfarben geben die Zusammensetzung der Lösung an jedem Punkt der Titration an — rot steht für H₃PO₄, rotviolett für H₂PO₄⁻, blauviolett für HPO₄²⁻ und blau für PO₄³⁻. Die fetten Punkte markieren Äquivalenzpunkte, die leeren Ringe Halbäquivalenzpunkte (pH=pKₐ, oder gleiche Konzentration H₃PO₄/H₂PO₄⁻, H₂PO₄⁻/HPO₄²⁻ bzw. HPO₄²⁻/PO₄³⁻).
Du siehst, daß an den ersten beiden Äquivalenzpunkten (V=20, 40 ml) ein Sprung auftritt. An diesen Sprungpunkten ist die Lösung einheitlich zusammengesetzt (es dominiert eine Spezies, nämlich rotviolettes H₂PO₄⁻ bzw. blauviolettes HPO₄²⁻). Der dritte Äquivalenzpunkt ist nicht als Sprung sichtbar, weil PO₄³⁻ hier die Lösung nicht dominiert — Phosphat ist ja wegen des hohen pK₃ eine ziemlich starke Base, und die Lösung besteht mehr als zur Hälfte aus HPO₄+OH⁻, nicht aus PO₄³⁻. Da hier aber ein Paar aus konjugierter Säure und Base vorliegt, puffert die Lösung — der pH ändert sich also nur wenig mit NaOH-Zugabe, und es tritt kein pH-Sprung auf.
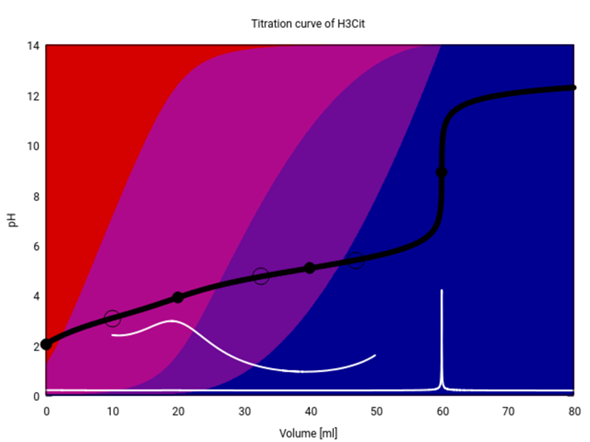
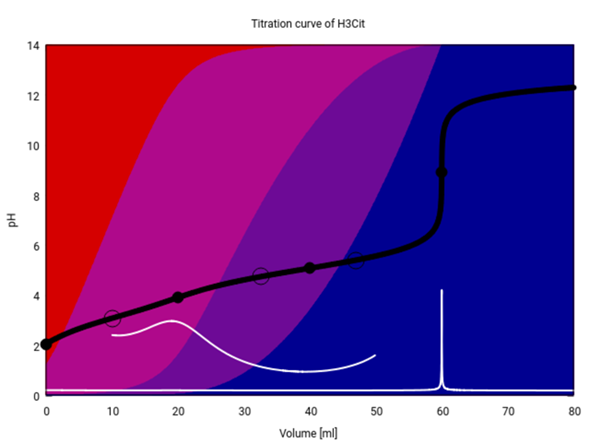
Das ist dieselbe Graphik für Zitronensäure. Sie sieht ganz anders aus, weil hier nur am dritten Äquivalenzpunkt (V=60 ml) ein pH-Sprung sichtbar ist: An diesem Punkt besteht die Lösung erstmalig nur aus einem einzigen Ionen, nämlich Citrat³⁻, daher puffert sie nicht und der pH kann endlich steigen. Bei kleinerem Verbrauch ha man dagegen immer eine Mischung von zwei oder gar drei verschiedenen Citrat-Spezies in der Lösung, d.h. die Suppe puffert, und der pH kann nicht steigen. Das liegt vor allem darin, daß die drei pKₐ-Werte eng beieinander liegen, daher beginnt z.B. die Bildung von HCit²⁻ (blauviolett) bereits, vor alle H₃Cit (rot) verbraucht ist (≈10 ml), und die Lösung hat niemals eine Chance, eines dieser Ionen allein zu enthalten (wie es bei der Phosphorsäure am 1. und 2. Äquivalenzpunkt der Fall war).