Titration mehrprotoniger Säure?
Wir hatten eine Kurve zur Titration von schwefeliger Säure gegeben, und die Lösungen waren wie folgt:

Dabei verstehe ich die Gleichgewichtsreaktionen nicht. Wieso reagiert HSO3- und SO32- mit Wasser, wenn es doch mit Natronlauge neutralisiert wird?
1 Antwort
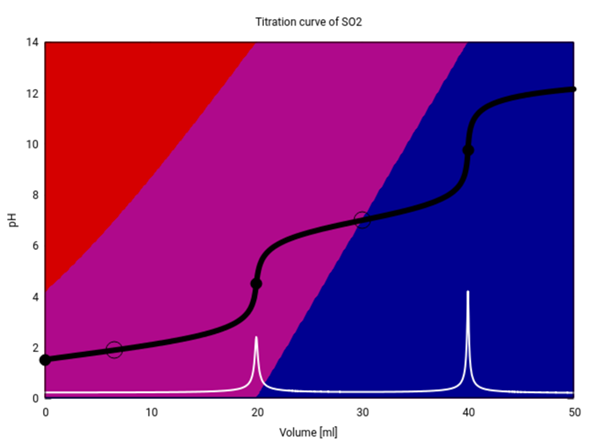
Hier siehst Du die Titrationskuve von SO₂ mit NaOH etwas genauer. Titriert weden 20 ml einer 0.1 mol/l SO₂-Lösung („schwefelige Säure“) mit 0.1 mol/l NaOH. Die beiden Äquivalenzpunkte liegen bei 20 bzw. 20 ml Verbrauch. Außer der Titrationskurve (schwarz) ist auch die erste Ableitung eingezeichnet (weiß), und die Hintergrundfarben codieren die Speziesverteilung: SO₂ („H₂SO₃“) ist rot, HSO₃¯ violett und SO₃²- blau.
Am Anfang liegt fast die Hälfte des Schwefels nicht als SO₂ vor, sondern als HSO₃¯, weil das SO₂ eine mittelstarke Säure ist und zwar nicht vollständig, aber doch merklich mit dem Wasser reagiert:
SO₂ + H₂O ⟶ H₃O⁺ + HSO₃¯
Deshalb liegt auch der pH mit 1.53 ziemlich tief (eine starke Säure hätte genau 1, also auch nicht viel saurer).
Nun kommt NaOH dazu, und der SO₂-Anteil sinkt, während der von HSO₃¯ steigt und der pH langsam ansteigt. Bei 6.6 ml Verbrauch haben wir gleich viel SO₂ und HSO₃¯ in der Lösung (deshalb pH=pKₐ₁), und dann haben wir immer weniger SO₂ in der Lösung, bis bei 20 ml SO₂ fast vollständig verschwindet und der pH springt.
Bei genau 20 ml Verbrauch liegt eine reine NaHSO₃-Lösung vor, und es gibt kein überschüssiges H₃O⁺ oder OH¯. Trotzdem ist der pH=4.5, also nicht 7, weil das HSO₃¯-Ion selbst mit dem Wasser reagieren kann: Es ist ein Ampholyt, kann also sowohl als Säure als auch als Base reagieren:
HSO₃¯ + H₂O ⟶ H₃O⁺ + SO₃²¯
HSO₃¯ + H₂O ⟶ OH¯ + „H₂SO₃“ ⟶ OH¯ + SO₂ + H₂O
Man kann sich ausrechnen, daß 0.32% nach der ersten und 0.25% nach der zweiten Gleichung reagieren, also kommt insgesamt eine leichter H₃O⁺-Überschuß zusammen, der den pH ins leicht Saure verschiebt. Das hat aber nichts mit der Titration zu tun, denselben pH würdest Du erhalten, wenn Du eine 0.05 mol/l NaHSO₃-Lösung aus Wasser und festem Natriumhydrogensulfit herstellst.
Danach, auf dem Weg von 20 zu 40 ml, kommt neue NaOH dazu, die das HSO₃¯ zu SO₃²¯ deprotoniert; genau in der Mitte liegt ein Pufferpunkt, an dem die beiden gleich konzentriert sind und daher pH=pKₐ₂ gilt. Bei 40 ml Verbrauch liegt eine reine Na₂SO₃-Lösung vor, und die reagiert alkalisch, weil Sulfit eine Base ist und in kleinem Ausmaß (1.7%, wenn man es durchrechnet) nach
SO₃²¯ + H₂O ⟶ OH¯ + HSO₃¯
reagiert und daher ein paar OH¯-Ionen produziert, die den pH auf 9.76 anheben. Denselben pH würdest Du auch erhalten, wenn Du eine 0.033 mol/l Lösung von festem Na₂SO₃ herstellst.
Danach kommt weitere NaOH dazu, die nichts mehr tut weil es nichts mehr zum Reagieren gibt; aber die darin enthaltenen OH¯-Ionen sammeln sich natürlich an und lassen den pH-Wert weiter ansteigen