Titrationskurven zeichnen, wie ansetzen?
Moin,
und zwar habe ich mich gefragt, wie ich den Start meiner Titrationskurve festlegen kann. Titriert man z.B. Salzsäure mit Natronlauge ist der Anfang der Kurve sehr gerade und leicht ansteigend. Bei der Titration von Essigsäure dagegen wird ja meistens schon am Anfang ein kleiner Anstieg am Startpunkt gezeichnet. Woran liegt das und wie weiß ich, was ich zu zeichnen habe?
1 Antwort
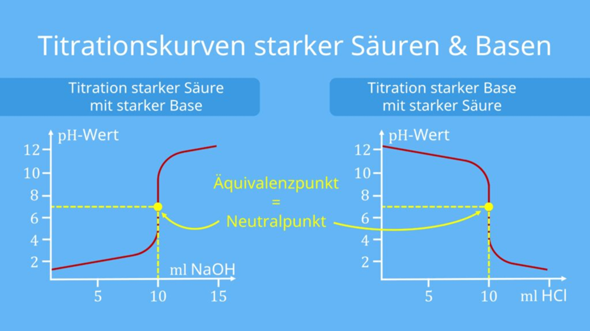
Fangen wir mit dem einfachsten aller Beispiele an, der Titration einer starken Säure mit einer starken Base. Das ist so einfach, daß man die Kurve leicht punktweise berechnen kann: Wenn man V₀ einer Salzsäure mit Konzentration c₀ vorlegt und dann mit NaOH der Konzentration c titriert, dann bekommt man nach Verbrauch V den pH
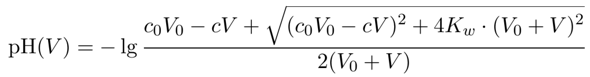
Diese Formel ist nicht schwer abzuleiten, und man kann es sogar noch einfacher haben, wenn man einfach stöchiometrisch vollständigen Umsatz annimmt und den Rest an Säure bzw. Base berechnet und logarithmiert; das braucht allerdings zwei verschiedene Formeln für vor und nach dem Äquivalenzpunkt, und die Vorgangsweise versagt in einem ganz schmalen Bereich rund um den Äquivalenzpunkt.
Das kannst Du also leicht selbst zeichnen.
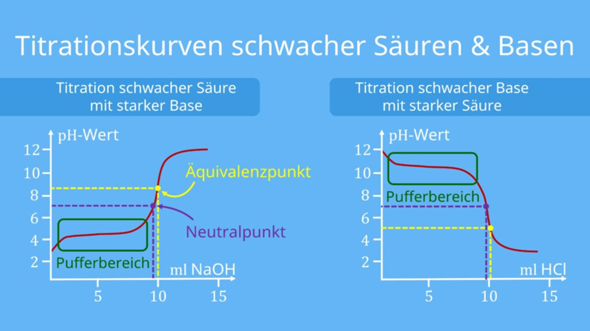
Bei der Titration schwacher Säuren mit NaOH ist es deutlich schwieriger; zwar gibt es eine Formel, aber die ist nur beschränkt praxistauglich, ich gebe sie nur der Vollständigkeit halber an. Sie ist sehr allgemein, man legt ein Volumen V₀ einer Lösung vor, die c₀ an einer schwachen Säure plus c₁ an starker Säure enthält, und titriert mit einer Natronlauge der Konzentration c. Um den pH-Wert zu berechnen, braucht man inverse Winkelfunktionen, die aus der Lösung der kubischen Gleichung stammen:

In der Praxis geht man eher so vor, daß man die Kurve punktweise berechnet. Der Anfangs-pH ist ja einfach nur eine schwache Säure bekannter Konzentration, und rund um den Halbäquivalenzpunkt gilt die Henderson–Hasselbalch-Gleichung. Am Äquivalenzpunkt hast Du die Lösung eines Salzes (= schwache Base), und nach dem Äquivalenzpunkt kannst Du näherungsweise annehmen, es liege reine NaOH vor (oder anders gesagt, Du kannst den hinteren Teil der Kurve für starke Säuren mit NaOH verwenden). Insgesamt ist auch das machbar.
Hier zeige ich eine ganze Kurvenschar mit verschiedenen pKₐ-Werten. Es werden jeweils 20 ml 0.1 mol/l der Säure mit 0.1 mol/l NaOH titriert:
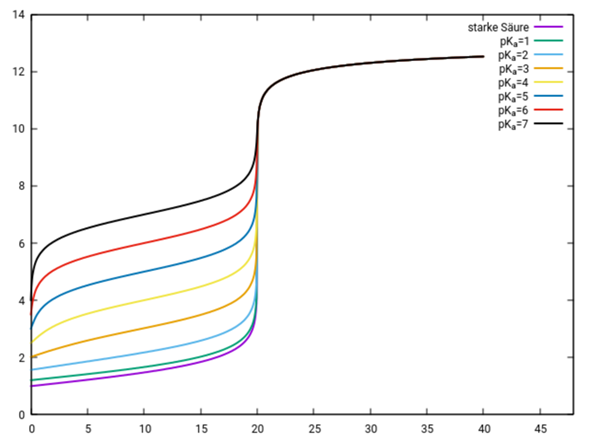
Du siehst, daß die mittelstarken Säuren (0 ≤ pKₐ ≤ 3) nicht ganz zum Rest passen, aber bei höherem pKₐ erkennt man leicht das ähnliche Aussehen: Man hat einen flachen Pufferbereich von grob 5 bis 15 ml Verbrauch (bei V=10 ml gilt pH≈pKₐ), und dann gibt es noch einen Anstieg davor und einen steilen Anstieg danach, der zum Äquivalenzpunkt führt. Nach dem Äquivalenzpunkt sehen alle Kurven ungefähr gleich aus, das hatte ich oben schon irgendwo erwähnt.
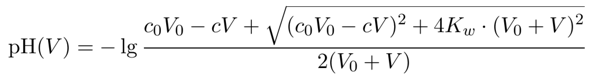

Erstmal vielen Dank für die Antwort, Junge das war ausführlich! Mega, danke dir! Ich glaub, ich habs tatsächlich jetzt mal verstanden.