Titration?
6. In einem Messkolben, der 100 cm3 fasst, wird ein Natriumhydroxid-Plätzchen gelöst.
20 cm3 dieser Lösung werden hierauf durch eine 0,1 molare Salzsäure unter Verwendung von Bromthymolblau als Indikator neutralisiert. Der Verbrauch an Salzsäure beträgt 16,5 ml. Bestimme die Konzentration der Natronlauge, sowie die Masse des Natriumhydroxid-Plätzchens.
1 Antwort
Man löst also ein Plätzchen NaOH in 100 ml Wasser und titriert ein 20-ml-Aliquot gegen eine c=0.1 mol/l HCl. Der Verbrauch beträgt V=16.5 ml.
Man hat also n=cV= 1.65 mmol HCl verbraucht, und das ganze NaOH-Plätzchen enthielt fünfmal soviel also 8.25 mmol NaOH, das sind m=nM=330 mg. Wie schwer das Pätzchen als ganzes war, ist aber daraus nicht abzuleiten, weil NaOH an der Luft H₂O und CO₂ anzieht und deshalb im Lauf der Zeit immer schwerer wird, natürlich ohne daß sich dabei die NaOH-Menge erhöht.
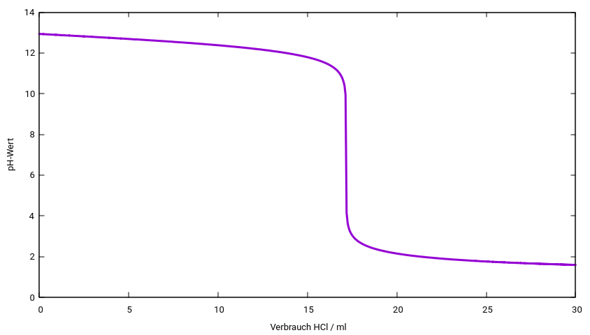
Und so würde die Titrationskurve aussehen:
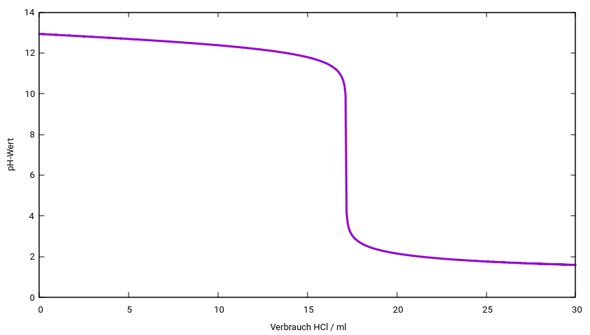
P.S.: Fehler in der Graphik behoben.