Stöchiometrie aufgaben?
Hallo,
unser, jetzt neuer Lehrer hat uns in der zehnten Klasse Aufgaben zur quantitativen Chemie gegeben. Nur haben wir in der Mittelstufe (8. bis 9.) NICHTS dergleichen gemacht, und ich weiß wirklich nicht, wo ich anfangen soll. Wenn es hier einige kompetente Leute gibt die helfen können, würde es mich sehr freuen. Liebe Grüße!
A1) Bei der Reaktion von Kupferoxid (CuO) mit Eisen hat man 5g Kupferoxid zur Verfügung. Wie viel Kupfer kann man daraus herstellen?
A2) Wie viel Gramm Schwefel reagieren mit 1g Silber zu Silbersulfid (Ag2S)?
A3) Wie viel Gramm CO2 entstehen bei der Reduktion von 20 g Bleioxid (PbO) mit Kohlenstoff? Berechne auch die Dichte.
Kann hier die allgemeine Formel n= m/M helfen? Die habe ich im Internet recherchiert, weiß aber auch nicht, wie ich das anwenden sollte...
2 Antworten
Hi,
ich erkläre dir einmal das allgemeine Vorgehen für Aufgabe A1 - dann hast du ein Werkzeug an der Hand, an dem du dich langhangeln kannst. Die Lösungen für die Aufgaben A2 und A3 darfst du gern in die Kommentare zur Kontrolle senden.
1) Reaktionsgleichung aufstellenDas steht immer am Anfang jeder stöchiometrischen Berechnung, da die Zahlen vor den Stoffen dir die Stöchiometrie der Reaktion liefern.
Es bleibt unklar, ob Eisen(II)-oxid (FeO) oder Eisen(III)-oxid (Fe2O3) entsteht. Ich gehe der Einfachheit halber mal von FeO aus. Die Rechnung für Fe2O3 wäre dieselbe, nur mit eben einem anderen stöchiometrischen Verhältnis.
Die Reaktionsgleichung ist CuO + Fe --> Cu + FeO.
2) Stöchiometrisches Verhältnis ermittelnAus der Reaktion kannst du nun das stöchiometrische Verhältnis (= Stoffmengenverhältnis) von gesuchter zu gegebener Größe ablesen. "Gesuchte Größe" bedeutet hier, dass der Stoff, von dem wir eine physikalische Größe (z. B. das Gewicht) suchen, in den Zähler des Bruches kommt. In den Nenner kommt die "gegebene Größe", also die Größe, von der wir die Angaben haben.
Hier wissen wir die Masse von Kupferoxid, weshalb n(CuO) in den Nenner kommt. Von Kupfer suchen wir die Masse, weshalb n(Cu) in den Zähler kommt. Wir nutzen n deshalb, weil uns die Faktoren vor den Stoffen in der Reaktionsgleichung die Verhältnisse der Stoffmengen angeben (es reagiert also z. B. 1 Mol mit 1 Mol oder im selben Verhältnis mit weniger Stoffmenge 0,5 mol mit 0,5 mol).
Nun kommt die Reaktionsgleichung ins Spiel: Wir schauen, welche Zahlen vor den Stoffen in der Gleichung stehen. Ist keine Zahl angegeben, so musst du dir eine 1 dazu denken. Es reagiert also 1 Mol Kupferoxid zu 1 Mol Kupfer. Das Verhältnis ist also 1 zu 1.
Da wir von CuO alles wissen, bringen wir n(CuO) durch Multiplizieren auf die rechte Seite.
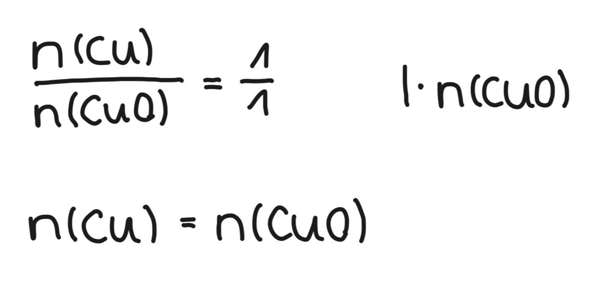
Hier kommt es nun drauf an, was gegeben ist. Bei der vorliegenden Aufgabe ist m(CuO) gegeben, die molare Masse M kann man im Periodensystem nachschlagen. Wir kennen M(CuO) also auch.
Von Kupfer suchen wir die Masse, also m(Cu). Die molare Masse M(Cu) kann man ebenfalls im Periodensystem nachschlagen. Wir ersetzen also beide n durch m/M.
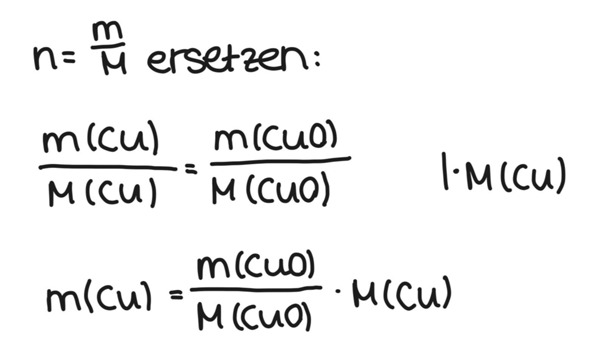
Wie du siehst, habe ich M(Cu) noch auf die rechte Seite gebracht. Nun haben wir also nur noch m(Cu) als Unbekannte.
4) Werte einsetzenDer Schritt ist denkbar trivial.
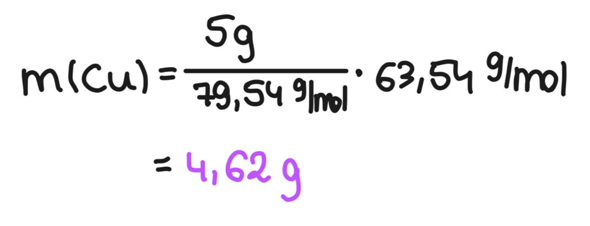
Nimm dir in Ruhe Zeit, das alles durchzulesen. Unser Ziel ist immer, eine Formel zu haben, in der wir einfach alles einsetzen können. Du kannst die Schritte auch einzeln berechnen, damit haust du dir aber viele Rundungsungenauigkeiten rein.
Bei Fragen melde dich!
LG
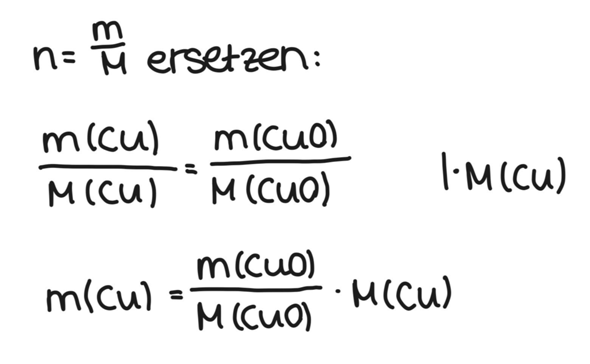
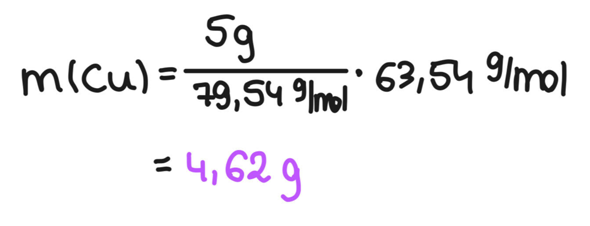
Gern geschehen! Freut mich, dass ich dir helfen konnte.
Mit der Formel liegst du da nicht falsch. Stoffmenge = Masse / Molare Masse.
Die Stoffmenge ist ein Maß für die Teilchenanzahl siehe Avogadro-Konstante.
Was du jetzt machen kannst ist ausrechnen wie viele Teilchen bez. mol du an Stoff zu verfügung hast. Wenn du das weißst, kannst du mit der selben Formel berechnen welche Masse andere Teilchen der selben Soffmenge haben.
Ich hoffe das war verständlich genug. Wenn du noch Fragen hast helfe ich gerne.
Die Erklärung hilft mir leider nicht, da ich nicht weiß wie ich bei den aufgaben überhaupt vorgehen soll, oder in welchem verhältnis die stoffe reagieren
ok also beim der ersten Aufgabe ist das Verhältnis egal. WAs du jetzt machst ist Ausrechnen mit der Formel welche Stoffmenge an CuO du hast. Damit kannst du dann die Masse von Cu berechnen. Die Molaren Massen beider Stoffe kannst du schnell googel. Dann ist es nur 2 mal in die Formel einsetzten das solltest du hinbekommen. Bei der 2. Aufgabe siehst du das du Ag2S hast also 2 Ag auf 1 S. Sprich du brauchst die doppelte Stoffmenge an Silber bez. die halbe an Schwefel, selbes vorgehen dann wie bei Aufgabe 1. Bei Aufgabe 3 kannst du ja mal überlegen wie es sein wird.
Ich kann dir auch dieses Video zu dem Thema empfehlen: Molare Masse und molares Volumen I musstewissen Chemie (youtube.com)
Ich bedanke mich wirklich sehr für die ausführliche Antwort!! Ich glaube, ich verstehs jetzt besser
kannst mir auch deine Lösung dann mitteilen. Dann sage ich dir auch ob es richtig ist
Ich bedanke mich sehr für die ausführliche Antwort. Nach einigem Anwenden werde ich schauen, ob ich noch Fragen habe bzw. ob die anderen Aufgaben richtig sind. Vielen lieben Dank nochmals!!!!