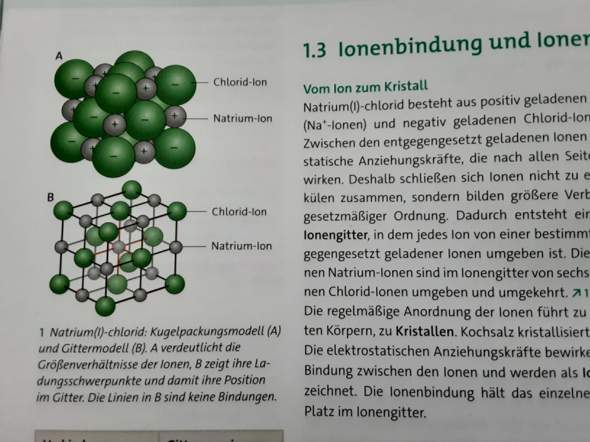
Ionengitter Chemie?
Hey,
Ich verstehe das nicht ganz. Die Ionen sind doch so gelagert, dass positive und negative nebeneinander liegen, die ziehen sich doch dann an, aber was macht die "elektrostatische Anziehungskraft" dann? (2. BILD) Wofür braucht man die, wenn sich die Ionen aufgrund ihrer Ladung schon anziehen? Warum bilden Ionen keine Moleküle, wenn sie sich anziehen? Und warum werden die Ionen im Gittermodell (1. Bild) so weit voneinander entfernt dargestellt?
Vielen Dank im Voraus