Woher weiß ich was als Säure und was als Base reagiert?
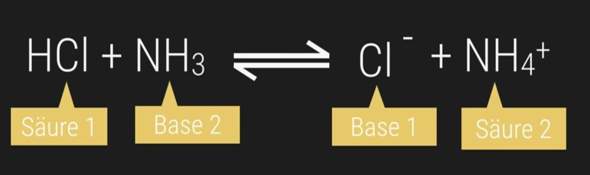
Könnte NH3 nicht theoretisch auch ein H+ (Proton) an HCl abgegeben? Dann wäre NH3 die Säure und HCl die Base.
4 Antworten
Das Reaktionsprodukt wären dann die sehr starke Base Amid und die extrem starke Säure H2Cl^+. Die neutralen Moleküle ab der dritten Periode lassen sich generell nur ungern protonieren. HF steht zum Beispiel analog zu Wasser im Gleichgewicht mit H2F^+ und F^-. Bei HCl beobachtet man das nicht.
Ja, Ammoniak kann als Säure reagieren. In flüssigem Ammoniak liegt z.B. ein Autoprotolyse-Gleichgewicht zwischen NH₃ und NH₄⁺+NH₂¯ vor, und mit Alkalimetallen bekommt man sogar Salze mit dem NH₂¯-Ion, z.B. Natriumamid
Na + NH₃ ⟶ NaNH₂ + ½ H₂
Das ist ganz analog zur Autoprotolyse des Wassers (zu H₃O⁺+OH¯) oder der Reaktion von Na mit H₂O zu NaOH. Es gibt sogar Natriumimid Na₂NH und Natriumnitrid Na₃N, also in Ammoniak sogar eine dreibasige Säure!
Aber nichts davon läuft in wäßriger Lösung. Denn das Amid-Ion ist eine so starke Base, daß es mit Wasser quantitativ zu NH₃+OH¯ reagiert, sich also in Anwesenheit von Wasser niemals bildet. NH₃ ist also eine extrem schwache Säure.
Umgekehrt ist HCl überhaupt keine Base; das protonierte H₂Cl⁺ existiert zwar in der Gasphase, aber nicht in kondensierter Phase; flüssiges HCl zeigt keine Autoprotolyse.
Daher funktioniert Deine vorgeschlagene Reaktion nicht.
Ammoniak kann theoretisch auch als Säure reagieren. Genauso wie Wasser kann auch Ammoniak sich selbst protonieren (Autoprotolyse) und dabei ein Ammonium-Ion NH4+ und ein Azanid-Ion NH2- bilden. NH2- ist aber selber eine sehr starke Base, folglich ist NH3 nur eine sehr schwache Säure.
Es hilft wohl einfach so 10 Säuren im Kopf zu haben...Ansonsten müsste man immer den pKs nachschauen!