Flammenfärbung Chemie, habe ich die Abbildung richtig verstanden?
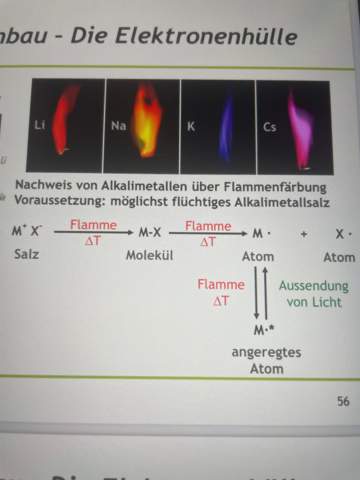
Also ganz grob habe ich es jetzt so verstanden: Salz wird erhitzt und spaltet sich in seine Atome auf. Das Metall bzw. die Elektronen des Metalls werden daraufhin angeregt und senden Lichtwellen aus. Bei Natrium wäre das jetzt bspw ungefähr bei bei 590nm
Also ich bin mir unsicher bei der Aufspaltung des Moleküls in seine Atome und ich bräuchte nochmal eine bessere Erklärung für das Ausstrahlen von Lichtwellen (also was genau mit dem Elektron dann passiert)
3 Antworten

Salze bestehen zunächst einmal aus Ionen. Beim Verdampfen können sich tatsächlich Moleküle bilden, aber die sind nur schwach gebunden und zerfallen beim weiteren Erhitzen in Ionen oder auch Atome. Wenn Du also NaCl in eine Flamme bringst, dann tanzt je nach Temperatur alles Mögliche in der Flamme herum, NaCl-Moleküle und die Ionen Na⁺ und Cl¯, aber auch die Atome Na und Cl (unter diesen Bedingungen bildet sich kein Cl₂).
Das, was die Flamme wirklich färbt, sind nur die Na-Atome. Deren äußerstes Elektron (das, das im Na⁺ fehlt) kann leicht angeregt werden und erzeugt dann das gelbe Licht.

Die Salze bestehen nicht aus Molekülen. Es sind Ionen...und die DIE sind dann mehr oder weniger in der Gasphase!
Zwar müssen die Atome, bzw. Ionen, bzw. Elektronen durch die Hitze angeregt werden (800 °C Brennerflamme!), aber das Licht wird frei, wenn die Elektronen in ihren Grundzustand zurück fallen!

Moin,
sag mal, von welchem Stümper oder welcher Stümperin hast du denn dieses Arbeitsblatt?
Salze bestehen nicht aus Molekülen oder Atomen, sondern aus Ionen (geladenen Teilchen, meinetwegen auf atomarem Niveau).
Das kannst du allgemein so darstellen:
MeA ⇌ Men+ + An–
Ein Salz (MeA) besteht aus Metallkationen (n-fach positiv geladene Ionen) und Anionen (n-fach negativ geladene Ionen).
Durch das Erhitzen erreichst du zwei Dinge: einerseits löst du die einzelnen Ionen aus dem Verbund der Ionen (aus dem Ionengitter, dem Salzkristall), so dass sie - mehr oder weniger frei - in die Gasphase gelangen können.
Aber vor allem werden durch die Energiezufuhr (in Form von Wärme) die Elektronen in den Ionenrümpfen angeregt.
Du weißt vielleicht, dass Atome aus einem winzig kleinen Atomkern und einer im Vergleich dazu riesigen Hülle bestehen?! Im Atomkern befinden sich ungeladene und positiv geladene Atombausteine, die Neutronen (ungeladen) und die Protonen (positiv geladen). In der Hülle befinden sich dagegen die negativ geladenen Elektronen. Weil es in Atomen stets gleich viele Protonen (Plusladungen) und Elektronen (Minusladungen) gibt, sind Atome elektrisch ungeladen.
Soweit, so klar, hoffe ich.
Bei Ionen ist das fast genau so, nur dass in den Elektronenhüllen ein bisschen weniger Elektronen als Protonen im Kern vorhanden sind (dann entstehen positiv geladene Kationen) oder eben ein bisschen mehr Elektronen in der Hülle als Protonen im Kern vorhanden sind (dann resultiert ein negativ geladenes Anion daraus).
Na ja, und nun ist es so, dass sich die Elektronen sowohl in Atomen als auch in Ionen anregen lassen. Das bedeutet, dass sie Energie (in Form von Wärme) aufnehmen und dabei ihren eigentlichen Platz in der Hülle (des Atoms oder Ions) kurzzeitig verlassen können.
Wenn sie dann auf ihren ursprünglichen Platz zurückkehren, müssen sie die zuvor aufgenommene Wärmeenergie wieder abgeben. Dieses Hin- und Herwechseln von Elektronen von ihrem Grundzustand in einen angeregten Zustand und zurück bezeichnet man als Quantensprünge. Das kommt daher, dass die Elektronen die Energie nicht in beliebiger Menge aufnehmen oder abgeben können, sondern nur in bestimmten Portionen (Quanten).
Der Clou an der Sache ist nun, dass die Energie, die zur Anregung der Elektronen führt, in praktisch jeder Form aufgenommen werden kann (in Form von Wärme, aber auch in Form von Elektrizität - siehe Edelgase). Aber die Energie, die die angeregten Elektronen wieder abgeben, um in ihren Grundzustand zurückzukehren, wird in Form von Licht abgestrahlt.
Tja, und je nachdem, in welchen Energieportionen (Quanten) das erfolgt, können wir das abgestrahlte Licht manchmal mit bloßem Auge sehen (zum Beispiel bei Lithium, Natrium, Kalium, Rubidium oder Cäsium...) oder eben nicht (zum Beispiel bei Magnesium, Chlor, Sauerstoff...). Dass wir das abgestrahlte Licht bei manchen Elementen (Atomen oder Ionen) nicht sehen können, heißt nicht, dass deren Elektronen nicht angeregt werden, aber es heißt, dass ihre Elektronen in solchen Energieportionen (Quanten) angeregt werden oder diese abstrahlen, dass sie in einem für unser Auge unsichtbaren Bereich des Spektrums liegen (zum Beispiel im UV-Bereich).
Mit bestimmten Messgeräten (Spektroskopen) kann man die Abstrahlungen der anderen Elemente sichtbar machen...
Aber die Alkalimetalle (Lithium, Natrium, Kalium, Rubidium oder Cäsium) strahlen alle im für uns sichtbaren Bereich des Spektrums ab, so dass sie sowohl in atomarer als auch in ionischer Form die rauschende Flame eines Gasbrenners einfärben (Flammenfärbung).
Ebenfalls im sichtbaren Bereich des Spektrums strahlen außerdem noch Calcium, Strontium, Barium, Radium, Kupfer, Europium, Antimon, Indium, Thallium, Selen.
Alles klarer, jetzt? Hast du noch Fragen?
LG von der Waterkant