Chemisches Gleichgewicht?
Hi, nh Frage zum Chemisches Gleichgewicht..Muss ich Q den Reaktionquotienten in meiner Rechnung beachten?
Bei der folgenden Aufgabe ist Q>K. Heißt ja dass die Reaktion Richtung Edukt abläuft. aber da K>1 ist bedeutet das dass zu t (ggw) mein Gleichgewicht auf der Produktseite. Wie schreibe ich dann meine Gleichung auf? Muss ich dann auf der Eduktseite +x rechnen?
zb
1 Antwort

3 H₂ + N₂ ⟶ 2 NH₃ K=0.11 l²/mol²
Du hast die Anfangskonzentrationen c₀(H₂)=0.003 mol/l, c₀(N₂)=0.001 mol/l und c₀(NH₃)=0.002 mol/l und willst wissen, was passiert.
Du kannst jetzt natürlich einen Konzentrationsquotienten Q=0.002²/0.003³/0.001 bilden und stellst fest, daß der irgendwo bei 10⁵ l²/mol² liegt, also Q≫K und die Reaktion wird von rechts nach links führen. Aber das kannst Du auch ignorieren, denn wir bekommen es aus dem weiteren Teil der Rechnung sowieso noch heraus.
Tun wir so, als ob wird das nicht wüßten und nehmen fälschlich an, daß die Reaktion von links nach rechts läuft. Dann würde Stickstoff verbraucht werden, nennen wir die Anzahl der verbrauchten N₂-Moleküle x. Dann würde sich die N₂-Konzentration um x erniedrigen, die der H₂-Moleküle um 3x, um im Gegenzug würde die NH₃-Konzentration um 2x steigen. Das setzen wir ins Massenwirkungsgesetz ein und lösen nach x auf:
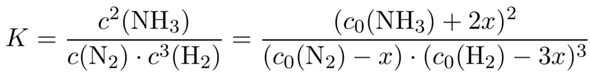
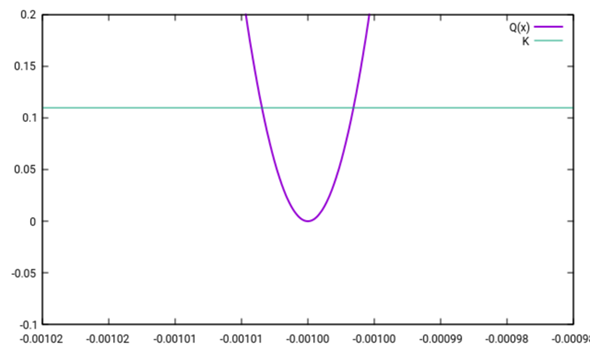
Diese Gleichung sieht so aus, als ob sie schwer zu lösen ist, also plotte ich einfach ganz faul den Wert für den Massenquotienten als Funktion von x (violett) und sehe, bei welchem x-Wert er den Wert der Gleichgewichtskonstanten (grün) erreicht.
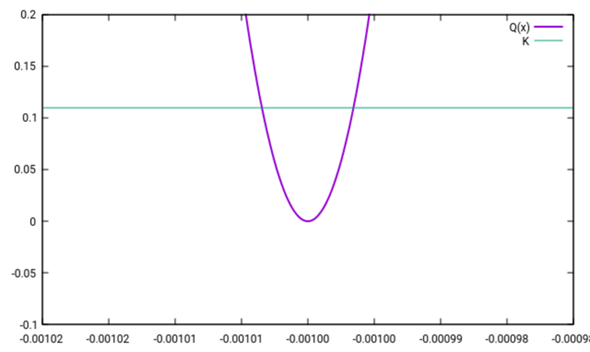
Es gibt zwei solche Schnittpunkte für x₁=−0.00100346 und x₂=−0.000996565 (nur graphisch geschätzt). Das negative Vorzeichen zeigt an, daß die Reaktion anders als angenommen abläuft: Wir hatten angesetzt, daß c(N₂)=c₀(N₂)−x und dabei geglaubt, daß die Reaktion Stickstoff verbraucht, aber die Rechnung ergibt, daß der Verbrauch negativ ist, also ein Zuwachs eintritt; die Reaktion läuft also von NH₃ zu N₂+H₂ ab.
- Für die erste Lösung x₁=−0.0010035 mol/l bekommen wir als Gleichgewichtskonzentrationen: c(N₂)=c₀(N₂)−x₁=0.0020035 mol/l, c(H₂)=c₀(H₂)−3x₁=0.006 mol/l und c(NH₃)=c₀(NH₃)+2x₁=−7⋅10¯⁶ mol/l. Das kann nicht stimmen, weil Konzentrationen immer positiv sind, also ist die Lösung zu verwerfen.
- Für die zweite Lösung x₂=−0.0009966 mol/l bekommen wir als Gleichgewichtskonzentrationen: c(N₂)=c₀(N₂)−x₂=0.001997 mol/l, c(H₂)=c₀(H₂)−3x₂=0.00599 mol/l und c(NH₃)=c₀(NH₃)+2x₂=6.8⋅10¯⁶ mol/l. Diese Lösung ist die richtige, weil alle Konzentrationen positiv und sie sowohl die Stöchiometrie als auch die Gleichgewichtsbedingung erfüllt.
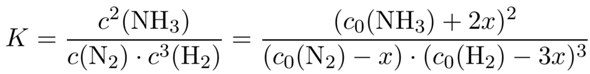

Ich fühle mich gebauchpinselt, daß Du meine faule Antwort mit einem solchen Lob adelst.
Danke auf ein Neues für die unfassbar ausführliche Antwort, wenn ich dich kennen würde, würde ich dir Plätzchen vorbeibringen