Chemie Strukturformel?
Hallo,
woher weiß ich ob die Strukturformel richtig ist, es gibt ja immer mehrere möglichkeiten es aufzuzeichnen?
Danke im Voraus🌸🌸🍀
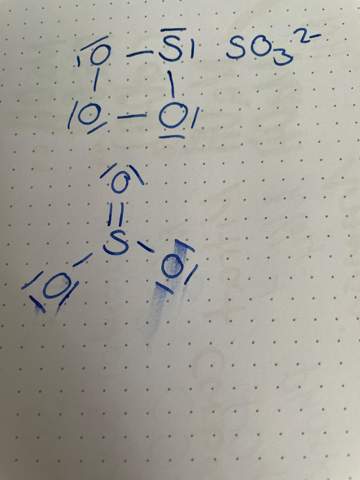
3 Antworten
Bei der oberen Strukturformel hast du keine doppelt negative Ladung. Allein deswegen ist die Struktur für SO3^2- schon falsch.
Abgesehen davon ist O sehr elektronegativ und will, wann immer möglich, vom Bindungspartner die Elektronen abziehen. Das kann er bei einem anderen O aber nicht (das ist vereinfacht gesagt der Grund warum Peroxide instabil sind). Daher wird es im SO3^2- wohl eher keine O-O Bindung geben. Außerm hat ein Vierring eine hohe Ringspannung. Das extrem unvorteilhaft für Bindungen. Ein solcher Ring fliegt also bei der ersten Gelegenheit auseinander.
Moin,
na ja, wenn es um das Sulfit-Anion (SO32–) geht, hast du zwar einerseits darauf zu achten, dass du einmal ein Schwefelatom und drei Sauerstoffatome verwendest, aber eben auch, dass es zwei negative Ladungen geben muss.
Ersteres hast du in deiner netten Viereck-Darstellung berücksichtigt, letzteres dagegen nicht.
Abgesehen davon ist Sauerstoff nur sehr ungern mit sich selbst verbunden. Und hier „verlangst” du von einem Sauerstoffatom, dass es das gleich zweimal erträgt. Eine solche Konstellation wäre extremst reaktiv. Aber das Sulfitanion ist ziemlich stabil. Das passt nicht zusammen...
Beim Zeichnen von Lewisformeln solltest du daher folgendes beachten:
- alle angegebenen Elementsymbole verwenden
- vorhandene Ladungen beachten
- alle Bindungspartner müssen (sollten) Edelgaskonfiguration haben (Wasserstoff zwei alle anderen Nichtmetallatome acht Valenzelektronen)
- Nichtmetallatome sind nur ungern mit ihresgleichen verbunden (Ausnahmen Kohlenstoff und Silicium), weil sich sonst sehr reaktive Moleküle ergeben (vgl. Wasserstoff, Sauerstoff, Peroxide, Ozon, Halogene)...
LG von der Waterkant
Die DreierKette aus Sauerstoff ist sehr instabil, geradezu explosiv. Sauerstoff bildet vor allem O2 (O=O), Ozon (O3, O=O-O) ist sehr instabil.
Meist besitzen solche Moleküle ein ZentralAtom, um das sich die anderen Atome gruppieren. Nur Kohlenstoff besitzt eine stark ausgeprägte Tenzenz, Molekülketten zu bilden.
Schwefel bindet sich auch an sich selbst, zB im Thiosulfat....In der SchulPraxis kommt das auch häufiger vor als Silane, die sich an der Luft von selbst entzünden.