Carboxylat Ion?
hi, kann mir jemand die Bindungsverhältnisse im Orbitalmodell des Carboxylat-Lat ions sagen? also es herrschen ja pi- elektronen… wie kann man das beschreiben bzw erklären? das Carboxylat ion hat ja zwei Mesomere Grenzstrukturen
1 Antwort
Moin,
so:
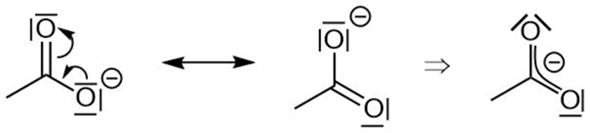
Wie du siehst, hat in der einen Grenzstruktur (Abbildung links) der untere Sauerstoff eine negative Ladung, weil er ein bindendes Elektronenpaar zum Carboxy-C-Atom hat und drei freie (nicht-bindende) Elektronenpaare.
Da alle drei Atome (zweimal O und einmal C) sp2-hybridisiert sind und das Ganze daher eine trigonal-planare Geometrie hat (alle diese Atome liegen in einer Ebene), verschmiert das pi-Elektronensystem über die drei beteiligten Atomrümpfe, so dass die pi-Elektronen delokalisiert sind (sie können keinem Atom fest zugeordnet werden; sie sind nicht auf einen Ort beschränkt = delokalisiert). Das deutet man in den Grenzstrukturen damit an, dass man die Elektronenpaare „umklappen” lässt (siehe eingezeichnete Pfeile an den Elektronenpaaren).
Das führt wiederum dazu, dass auch das zweite Sauerstoffatom die negative Ladung haben kann, wie es in der mittleren Grenzstruktur (Abbildung Mitte) zu sehen ist.
Daraus folgt dann, dass die tatsächliche Struktur irgendwo in der Mitte zwischen den beiden Grenzstrukturen liegt (die negative Ladung wird zwischen den beiden Sauerstoffatomen verteilt, wie es die Abbildung rechts zeigt).
Das nennt man Mesomerie. Ein Molekül, in dem du mesomere Grenzstrukturen formulieren kannst, ist stabiler als jede einzelne der Grenzstrukturen für sich. Deshalb spricht man in diesem Zusammenhang auch von einer Mesomeriestabilisierung bzw. von mesomeriestabilisierten Teilchen. Je mehr Grenzstrukturen du formulieren kannst, desto größer ist die Mesomeriestabilisierung...
LG von der Waterkant
Ja, die freien Elektronenpaare des Sauerstoffs sind nicht-bindende (deshalb freie!) Elektronenpaare und „machen nichts mehr”...
Und ja, am Carboxylat-Kohlenstoff ist noch etwas gebunden. Bei der „Ameisensäure” (Methansäure) wäre das ein Wasserstoffatom, das in der Tat über eine sigma-Bindung mit einem der drei sp^2-Hybridorbitale des Kohlenstoffatoms eine Bindung ausbilden würde.
Aber selbst wenn der Carboxylat-Kohlenstoff mit einem anderen Kohlenstoffatom verbunden wäre, ergäbe sich hier eine sigma-Bindung...
Das Carboxylat-C-Atom hat also insgesamt drei sigma-Bindungen (zwei zu den beiden Sauerstoffatomen plus eine zu einem Wasserstoff- oder anderen Kohlenstoffatom) sowie eine pi-Bindung, die über beide Sauerstoffatome verteilt ist (delokalisiertes pi-Elektronensystem).
bei dem Carboxylat-C-Atom überlappen dann die sp3-Hybridorbtialle mit den Hybridorbitalen der O-Atolen miteinander und bilden dann jeweils eine sigma bindung?
Das Carboxylat-C-Atom hat keine sp3-Hybridorbitale. Es ist sp2-hybridisiert!
genau, die sp2- Hybridorbitale überlappen mit den Hybridorbitalen der O-Atomen miteinander und bilden dann jeweils eine sigma-Bindung?!
oh perfekt danke für die gute erklärung! kannst du mir noch sagen, wie viele sigma bindungen noch entstehen? also diese freie Elektronenpaaren der beiden O Atomen machen nichts mehr oder wie? und am C-Atom ist ja noch ein H-Atom grundsätzlich noch drangebenden.. überlappt sich das Hybridorbitals des C-Atoms mit dem s-Obrital des H-Atoms zu einer Sigma Bindung?