[Chemie] Versuch: Natrium und Chlor?
Guten Abend,
leider verstehe ich diesen Aufschrieb noch überhaupt nicht und ich verstehe auch noch nicht genau, wie ich diese Kreise erstelle, wie diese Kreise heißen, und wie die verschiedenen Punkte in die Kreise verteilt werden müssen. Und wofür in der Mitte der Kreise diese Zahl steht (mit einem hochgestellten +). Im Periodensystem der Elemente sehe ich, dass die Ordnungszahl für die Zahl in den Kreisen immer genommen wurde, aber was sagt die Ordnungszahl überhaupt aus? Zudem weiß ich nicht, wie man die Punkte unten bei „Na“, „Cl“ und „Na+Cl“ drumherum anordnen muss und wie viele Punkte man hier nehmen muss und was diese Punkte aussagen.
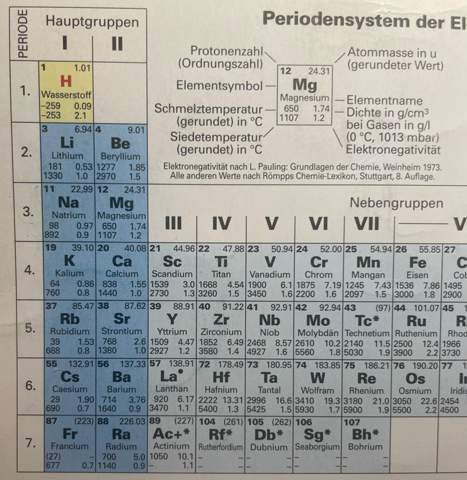
Ich weiß zudem auch nicht, was ein Kation und was ein Amion ist (noch nie gehört, nur schriftlich durch den Tafelaufschrieb vom Lehrer gelesen). Auch weiß ich nicht, wieso auf der linken Seite bei „Na“ und bei „Cl“ kein „+“ und kein „-” steht, aber auf der rechten Seite bei „Na“ und bei „Cl“ schon. Wofür steht hier überhaupt das „-“ und das „+“?
(Ich habe seit diesem Schuljahr das erste mal in meinem Leben Chemie und schreibe auch dieses Schuljahr mein Abitur.)
Ich freue mich über eure hilfreichen und leicht verständlichen Antworten.
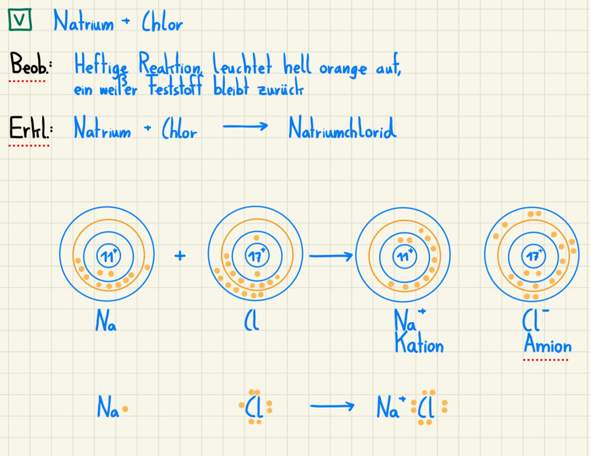
Ergänzung zu Sr (also Strontium) nach dem Borschen Atommodell:
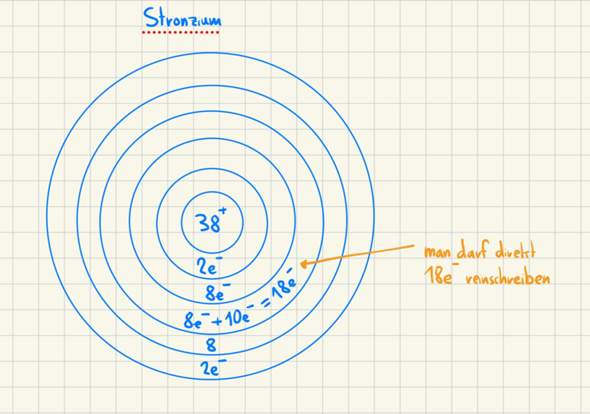
Cl (Chlor) nach dem Borschen Atommodell:
1 Antwort
Hi,
wir versuchen mal, das Schritt für Schritt durchzugehen.
Im Periodensystem der Elemente sehe ich, dass die Ordnungszahl für die Zahl in den Kreisen immer genommen wurde, aber was sagt die Ordnungszahl überhaupt aus?
Also: Es gibt Atome und Ionen. Ein Atom ist die kleinste Einheit eines Elements. Es besteht aus Protonen, Elektronen und Neutronen.
Die Angaben im Periodensystem verraten uns sehr viel über das Atom:
- Ordnungszahl: Gibt die Anzahl der Protonen (und Elektronen) in einem Atom an. Deshalb wurde sie auch in die Kreise geschrieben.
- Massenzahl: Sagt uns, wie viel ein Atom (in u) wiegt. Die Massenzahl setzt sich zusammen aus der Masse an Protonen (je Proton 1 u Masse) und Neutronen (auch je 1 u). Das heißt, die Masse eines Atoms wird maßgeblich durch den Atomkern bestimmt, der aus Protonen und Neutronen besteht. Wenn du von der Masse also die Ordnungszahl abziehst, erhältst du die Anzahl der Neutronen.
- Hauptgruppe: Gibt an, wie viele Elektronen auf der äußersten Schale des Atoms sind (Valenzelektronen).
- Periode: Gibt die Anzahl der Schalen an.
ich verstehe auch noch nicht genau, wie ich diese Kreise erstelle, wie diese Kreise heißen, und wie die verschiedenen Punkte in die Kreise verteilt werden müssen. Und wofür in der Mitte der Kreise diese Zahl steht (mit einem hochgestellten +).
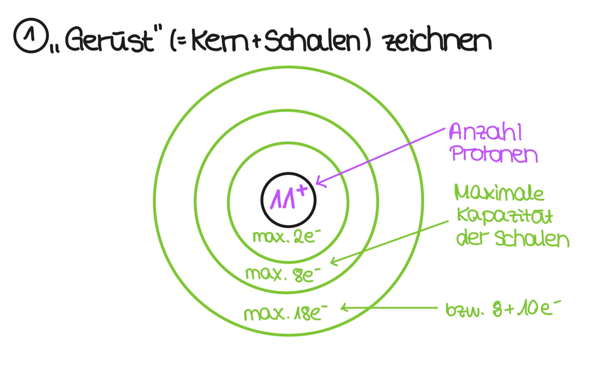
Ich erkläre dir am Beispiel Natrium, wie man nach dem Bohrschen Atommodell ein Natriumatom zeichnet. Zunächst übernimmst du die Informationen, die du zu Natrium im Periodensystem findest, und interpretierst sie:

Wenn das geschehen ist, dann kümmerst du dich erstmal um das "Gerüst" des Atoms. Das heißt: Du zeichnest den Kern (der Kreis in der Mitte), trägst die Anzahl der Protonen ein und machst ein + oben rechts an die Zahl. as sagt aus, dass der Kern aus 11 Protonen besteht (und ein Proton hat ja eine Ladung von +1). Dann zeichnest du erstmal alle Schalen auf:
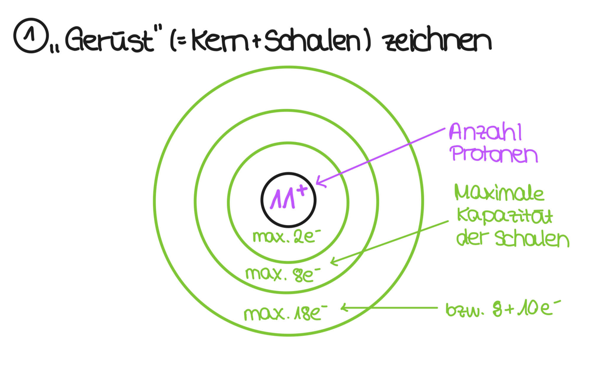
Du siehst, dass ich in die Schalen was von maximaler Elektronenzahl aufgeschrieben habe. Um das zu verstehen, schaust du am besten mal ins Periodensystem. Du siehst, dass in der ersten Periode nur H (also Wasserstoff) und He (also Helium) stehen. Das heißt: Nach zwei Elektronen ist diese Schale voll. Die nächste Schale kann schon acht Elektronen aufnehmen, da in der Reihe Lithium, Beryllium etc stehen, bis hin zum Neon. Auch bei der dritten Schal ist dies so. Warum aber habe ich da "18 bzw. 8 + 10" hingeschrieben? Das liegt daran, dass in der nächsten Periode die Nebengruppenelemente kommen und die die Schale davor auffüllen. Das heißt, die Nebengruppenelemente in Periode 4 füllen die dritte Schale auf. Für unseren Zweck reicht es aber, dass es erstmal die 8 Elektronen aus der dritten Periode maximal aufnehmen kann.
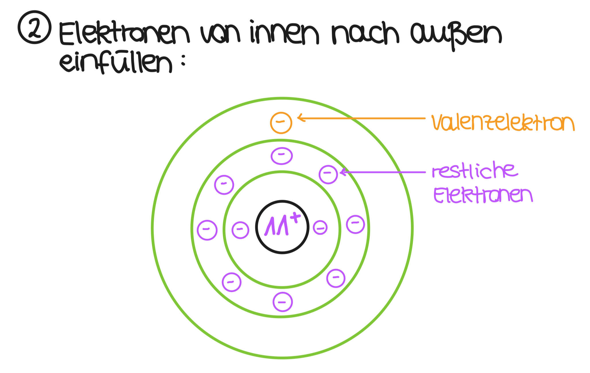
Nun hast du 11 Elektronen. Diese füllst du von innen nach außen auf:
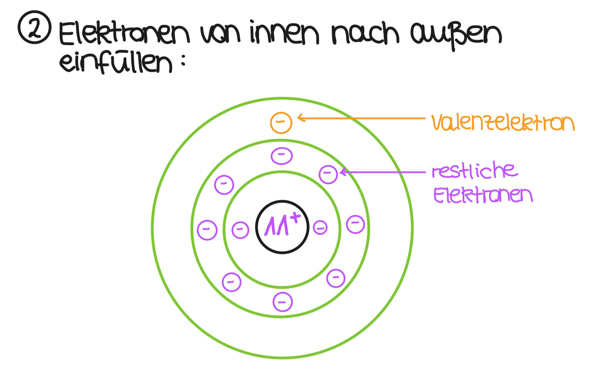
Wenn du das so machst, hast du deine 11 Elektronen passend eingefüllt und, wie es die Hauptgruppe schon vorgibt, ein Elektron auf der äußersten Schale. Damit ist die Zeichnung des Natriumatoms schon fertig. Probiere es doch gleich mal für Chlor, um zu gucken, ob du meine Erläuterungen verstanden hast.
Zudem weiß ich nicht, wie man die Punkte unten bei „Na“, „Cl“ und „Na+Cl“ drumherum anordnen muss und wie viele Punkte man hier nehmen muss und was diese Punkte aussagen.
Um Atome in Lewis-Schreibweise darzustellen, gehst du wie folgt vor:
- Du suchst das Element im Periodensystem. Die Hauptgruppe gibt die Anzahl der Außenelektronen (= Valenzelektronen) vor.
- Du notierst das Elementsymbol.
- Du fängst an einer Seite an, einen Punkt zu setzen, und gehst im oder gegen den Uhrzeigersinn um das Element herum; ein Element hat maximal vier einzelne Elektronen (Punkte) um sich herum.
- Hat dein Atom mehr als vier Valenzelektronen, fängst du wieder von vorm an und zeichnest neben den ersten Punkt noch einen zweiten Punkt (bei 5 VE), neben den zweiten auch (bei 6 VE) u.s.w.
- Wenn du alle Valenzelektronen notiert hast, guckst du, wo überall zwei Punkte nebeneinander stehen. Dort machst du aus den zwei Punkten einen Strich.
Du hast also am Ende ein Elementsymbol mit Punkten (bis 4 VE), Punkten und Strichen (5 bis 7 VE) oder nur Strichen (bei 8 VE). Für Chlor heißt das:
- Chlor steht in der 7. Hauptgruppe, hat also 7 Valenzelektronen.
- Das Elementsymbol Cl notierst du.
- Dann zeichnest du die vier Punkte an den vier Seiten ein. Drei Elektronen bleiben übrig.
- Du fängst wieder von vorn an und zeichnest neben das erste Elektron direkt ein zweites. Das machst du noch zwei weitere Male. Dann hast du Cl mit einem einzelnen Punkt und drei Mal zwei Punkten nebeneinander.
- Die Elektronenpaare verbindest du zu einem Strich. Dann hast du ein Cl mit drei Strichen und einem Punkt.
Die Darstellung für NaCl finde ich unglücklich gewählt, weil hier die Ionenschreibweise und die Lewis-Schreibweise gemischt werden. Es soll aber Folgendes aussagen: Bei einer Reaktion werden Elektronen übertragen. Natrium hat ein Valenzelektron, Chlor hat sieben Valenzelektronen. Die Atome sind bestrebt, ein Elektronenoktett zu erreichen (also eine volle äußerste Schale) zu haben. Um das zu erreichen, gibt Natrium sein Valenzelektron an das Chlor ab, sodass beide Ionen acht Außenelektronen haben. Das heißt, Chlorid (das Anion - was das ist, siehe nächster Punkt) hat nun acht Außenelektronen, was vier Doppelpunkten (bzw. dann eigentlich vier Strichen) entspricht. In der Ionenschreibweise wäre das Na(+) Cl(-).
Ich weiß zudem auch nicht, was ein Kation und was ein Anion ist (noch nie gehört, nur schriftlich durch den Tafelaufschrieb vom Lehrer gelesen).
Ein Atom kann Elektronen abgeben und/oder aufnahmen. Dabei wird das Atom zu einem geladenen Teilchen, einem sogenannten Ion. Ionen können eine positive oder negative Ladung haben. Auch Moleküle können Ionen sein.
Ein Kation hat eine positive Ladung. So wird Natrium zu einem Na(+)-Kation (lies: "Natrium-Kation"), wenn es sein Valenzelektron abgibt und eine positive Ladung erhält (ihm fehlt ja jetzt ein Elektron).
Ein Anion hat eine negative Ladung. So wird Chlor zu einem Cl(-)-Anion (lies: "Chlorid-Anion"), wenn es das Valenzelektron des Natriums aufnimmt und eine negative Ladung erhält (es hat jetzt ein Elektron "zu viel").
Auch weiß ich nicht, wieso auf der linken Seite bei „Na“ und bei „Cl“ kein „+“ und kein „-” steht, aber auf der rechten Seite bei „Na“ und bei „Cl“ schon. Wofür steht hier überhaupt das „-“ und das „+“?
Links stehen keine Ladungen, weil die elektrisch neutralen Atome miteinander reagieren. Zu Beginn hat jedes der Atome noch alle seine Valenzelektronen. Erst bei der Reaktion werden die Valenzelektronen vom Natrium aufs Chlor übertragen und es entstehen die eben angesprochenen Ionen.
Das + und das - geben die Ladungen der beteiligten Ionen an. Natrium hat die Ladung +1 (die 1 schreibt man nicht mit), da es ein Valenzelektron abgegeben hat und somit nur noch 10 Elektronen, aber 11 Protonen hat. Es hat also ein Elektron zu wenig und hat eine positive Ladung. Das schriebt man als + im Exponenten. Für Chlor ist es umgedreht: Nach der Reaktion hat es 18 Elektronen, aber nur 17 Protonen, also ein Elektron zu viel. Somit hat es die Ladung -1, was als - im Index gekennzeichnet wird.
Ich hoffe, ich konnte die Fragen hinreichend beantworten - falls noch was unklar geblieben ist, frag nach.
LG

[2]
Für unseren Zweck reicht es aber, dass es erstmal die 8 Elektronen aus der dritten Periode maximal aufnehmen kann.
Das verstehe ich leider noch nicht so ganz. Das wäre doch nur bei Elementen der dritten Periode so, da die Elemente in der äußersten Schale immer so viele Elektronen haben, wie die Nummer der Hauptgruppe (Valenzelektronen). Und die Hauptgruppen gehen ja nur bis 8, also können Elemente der 3. Periode in der 3. und somit der äußersten Schale maximal 8 Elektronen habe. Ar (also Argon) hat in der 3. Schale und somit der äußersten Schale 8 Elektronen (= Hauptgruppe).
Probiere es doch gleich mal für Chlor, um zu gucken, ob du meine Erläuterungen verstanden hast.
Siehe zweite Ergänzung der Frage.
Du fängst an einer Seite an, einen Punkt zu setzen, und gehst im oder gegen den Uhrzeigersinn um das Element herum; ein Element hat maximal vier einzelne Elektronen (Punkte) um sich herum.
Hat dein Atom mehr als vier Valenzelektronen, fängst du wieder von vorm an und zeichnest neben den ersten Punkt noch einen zweiten Punkt (bei 5 VE), neben den zweiten auch (bei 6 VE) u.s.w.
Wenn du alle Valenzelektronen notiert hast, guckst du, wo überall zwei Punkte nebeneinander stehen. Dort machst du aus den zwei Punkten einen Strich.
Jetzt macht es endlich mehr Sinn. Mein Lehrer schrieb auf dem hier geteilten Aufschrieb ja nur Punkte, in der heutigen Stunde zeichnete er Striche. Er hat uns nie gezeigt, dass man diese Punkte im Kreis herum abwechselnd anordnet und zwei Punkte nebeneinander dann zu einem Strich werden. Heute schrieb er einfach ohne jegliche Erklärung die Striche (ohne vorher Punkte zu zeichnen und sie zu einem Strich zu verbinden).
Die Darstellung für NaCl finde ich unglücklich gewählt, weil hier die Ionenschreibweise und die Lewis-Schreibweise gemischt werden. Es soll aber Folgendes aussagen: Bei einer Reaktion werden Elektronen übertragen. Natrium hat ein Valenzelektron, Chlor hat sieben Valenzelektronen. Die Atome sind bestrebt, ein Elektronenoktett zu erreichen (also eine volle äußerste Schale) zu haben. Um das zu erreichen, gibt Natrium sein Valenzelektron an das Chlor ab, sodass beide Ionen acht Außenelektronen haben.
Spricht man immer nicht mehr von einem Atom, sondern von einem Ion, wenn Elemente Elektronen abgegeben bzw. aufgenommen haben?
Ein Kation hat eine positive Ladung. So wird Natrium zu einem Na(+)-Kation (lies: "Natrium-Kation"), wenn es sein Valenzelektron abgibt und eine positive Ladung erhält (ihm fehlt ja jetzt ein Elektron).
Ein Anion hat eine negative Ladung. So wird Chlor zu einem Cl(-)-Anion (lies: "Chlorid-Anion"), wenn es das Valenzelektron des Natriums aufnimmt und eine negative Ladung erhält (es hat jetzt ein Elektron "zu viel").
Also spricht man von einem Kation, wenn es eine positive Ladung hat. Und positive Ladung bedeutet in diesem Fall einen Überschuss an Protonen? Da es mehr Protonen gibt schreibt man also ein + hin, oder? Denn plus ist ja die Einheit für die Protonen. Und hier gibt es einen Überschuss. Theoretisch steht hier also +1 für den Überschuss eines Protons?
Wenn ein Ion eine negative Ladung hat, spricht man von einem Anion. Und negative Ladung bedeutet, dass es einen Überschuss an Elektronen gibt? Also gibt es mehr Elektronen als Protonen, oder? Daher schreibt man hier ein - hin, denn es gibt einen Überschuss an Elektronen und - ist die Einheit der Elektronen. Theoretisch steht hier also -1 für den Überschuss eines Elektrons?
„Kation“ und „Amion“ haben ja die Endungen „Ion“, da es sich um Ionen handelt. Aber wofür steht das „Ka“ und das „Am“ bzw. wie kann man sich am besten merken, dass Ionen mit einem Protonenüberschuss Kationen heißen und Ionen mit einem Elektronenüberschuss Amion heißen?
Das + und das - geben die Ladungen der beteiligten Ionen an. Natrium hat die Ladung +1 (die 1 schreibt man nicht mit), da es ein Valenzelektron abgegeben hat und somit nur noch 10 Elektronen, aber 11 Protonen hat. Es hat also ein Elektron zu wenig und hat eine positive Ladung. Das schriebt man als + im Exponenten. Für Chlor ist es umgedreht: Nach der Reaktion hat es 18 Elektronen, aber nur 17 Protonen, also ein Elektron zu viel. Somit hat es die Ladung -1, was als - im Index gekennzeichnet wird.
Das macht so viel Sinn, wenn man es dann endlich verstanden hat! :-) Vielen lieben Dank für deine super Antwort 🙏🤩
Danke erstmal für dein Lob :)
Wieso spricht man davon, dass aufgrund der Tatsache, dass in der ersten Periode nur H (also Wasserstoff) und He (also Helium) stehen, die Schale nach zwei Elektronen voll ist bzw. nur maximal zwei Elektronen aufnehmen kann?
Na ja, die erste Hauptgruppe hat ja nur Wasserstoff und Helium, und Helium ist ein Edelgas. Es kann also maximal zwei Valenzelektronen haben. In der nächsten Periode gibt es acht Hauptgruppenelemente. Also maximal acht Valenzelektronen.
Ab hier bin ich raus und wüsste nicht, wie man das macht, da ja von der 4. Periode bzw. der 4. Schale die Nebengruppen in die 3. Schale „gerutscht sind“.
Also: Ab der vierten Periode treten die Nebengruppenelemente hinzu. Hier wird es, wenn man es chemisch korrekt betrachtet, recht komplex. Vereinfacht gesagt: Die Elektronen in den Nebengruppen verhalten sich anders als Hauptgruppenelektronen. Deshalb parkt man sie in der dritten Periode und die Metallatome in den Nebengruppen haben eben die zwei Valenzelektronen aus den Hauptgruppen 1 und 2. Eigentlich ist das noch viel viel komplexer, um das wirklich verstehen zu können. müsstest du dich mit so Zeugs wie Orbitalen und Ligandenfeldtheorie befassen. Das ist aber Kram für die gymnasiale Oberstufe bzw. das Studium.
Du hast das Beispiel Strontium gebracht. Die fünf Schalen zeichnest du nach wie vor und füllst bis Strontium erstmal ganz normal auf, wie ich es erklärt habe. Die Nebengruppen ignorieren wir erstmal. Wenn du das hast, können wir uns nochmal um die vierte Periode kümmern. Es gibt zehn Nebengruppenelektronen, sodass du jetzt aus der vierten Periode noch zehn Elektronen zu verteilen hast. Da das aber die Elektronen in der vierten Periode sind, füllen die die dritte Schale auf. Dort hast du dann 18 Elektronen. Die Abfolge ver Elektronen von innen nach außen ist also 2 - 8 - 18 - 8 - 2. Macht in Summe 38 und da Strontium die Ordnungszahl 38 hat, passts.
Das verstehe ich leider noch nicht so ganz. Das wäre doch nur bei Elementen der dritten Periode so, da die Elemente in der äußersten Schale immer so viele Elektronen haben, wie die Nummer der Hauptgruppe (Valenzelektronen).
Ja, das ist alles richtig. Sorry, falls ich dich verwirrt habe - was ich meinte, ist: Na klar kann die dritte Schale insgesamt 18 Elektronen aufnehmen, aber da sie ja die äußerste Schale ist, kann sie eben nur acht Elektronen maximal aufnehmen. Du liegt mit deiner Argumentation goldrichtig.
Siehe zweite Ergänzung der Frage.
Vollkommen korrekte Darstellung!
Spricht man immer nicht mehr von einem Atom, sondern von einem Ion, wenn Elemente Elektronen abgegeben bzw. aufgenommen haben?
Richtig. Auch deine Ausführungen zu Anionen (nicht Amionen ^^) und Kationen passen so. Und wie man sich das merkt? Gute Frage. Ich habe es im Anfangsunterricht auch öfter mal verwechselt.
[1] Erst einmal vielen lieben Dank für deine wirklich perfekte Antwort, durch die ich jetzt schon viel mehr verstehe 🤩
Diese Antwort könnte man echt als Lehrer/-in in ein Dokument einfügen und als Lernblatt für die Schüler austeilen… Im allgemeinen „Fragen und Antworten“ die die Schüler stellen - so wie ein FAQ auf einer Webseite.
Ein paar Fragen habe ich aber noch, da ich noch nicht alles perfekt verstanden habe:
Wieso spricht man davon, dass aufgrund der Tatsache, dass in der ersten Periode nur H (also Wasserstoff) und He (also Helium) stehen, die Schale nach zwei Elektronen voll ist bzw. nur maximal zwei Elektronen aufnehmen kann?
Denn: Die Ordnungszahl (Protonenanzahl) entspricht ja auch der Anzahl der Elektronen.
Wieso sagt man nun aber, dass die 1. Schale nach 2 Elektronen voll ist, obwohl die Summe der Elektronen von H (also Wasserstoff) und He (also Helium) 3 Elektronen beträgt (1 Elektron von Wasserstoff plus 2 Elektronen von Helium)?
Das kann ich mir auf jeden Fall gut merken.
Nun stellt sich mir aber die Frage, da man ja bestimmt nicht nur Elemente der 3. Periode / Elemente mit 3 Schalen nach dem Bohrschen Atommodell darstellen kann, sondern bestimmt auch Elemente mit niedrigerer oder höherer Schalenanzahl, wie man dann dort vorgehen muss.
Nun zu Elementen der 1. Periode. Was wäre zum Beispiel bei H (also Wasserstoff)? Da gibt es nur eine Schale und in dieser einen Schale befindet sich ein Elektron, also 1e^- bzw. (-).
Bei Helium gibt es also auch nur eine Schale (1. Periode) und in dieser einen Schale sind zwei Elektronen (da die Protonenzahl (Ordnungszahl) bei Helium 2 ist), also 2e^- bzw. (-) (-).
Nun Elementen der 2. Periode. Bei Lithium steht im Kern 3^+ für die 3 Protonen. Also gibt es auch 3 Elektronen, die man nun auf die 2 Schalen (Lithium hat die 2. Periode) verteilen muss. Um herauszufinden, wie viele Elektronen maximal in eine Schale kommen können, zählt man nun die Elemente in der jeweiligen Reihe (Achtung: Bei der 3. Reihe kommen die Nebengruppen der 4. Reihe hinzu, sie füllen die 3. Reihe auf.). Die 3 Elektronen werden bei Lithium also folgendermaßen verteilt: In der 1. Schale befinden sich 2 Elektronen (da es in der 1. Periode 2 Elemente gibt) und in der 2. Schale befindet sich 1 Elektron, da 1 Elektron übrig bleibt. Übrigens sieht man auch direkt an der Hauptgruppe von Lithium, welche 1 ist, dass ein Valenzelektron in die äußerste Schale kommt, also alles richtig gemacht.
Nun zu Elementen der 3. Periode. Beispiel Si (also Silicium). Silicium hat die Protonenanzahl (Ordnungszahl) 14 und somit steht im Atomkern 14^+ für die 14 Protonen. Nun müssen die 14 Elektronen verteilt werden. Was wir schon wissen: Es gibt 3 Schalen (3. Periode) und in der dritten und letzten Schale befinden sich 4 Elektronen (= Hauptgruppe. 1. Schale: 2 Elektronen, 2. Schale: 8 Elektronen, 3. Schale: 4 Elektronen (14-2-8=4 bzw. =Hauptgruppe).
Nun zu Elementen der 4. Periode. Ab hier bin ich raus und wüsste nicht, wie man das macht, da ja von der 4. Periode bzw. der 4. Schale die Nebengruppen in die 3. Schale „gerutscht sind“.
Wie geht man hier vor? In der Schule haben wir einen Aufschrieb von Sr (also Stronzium) gemacht. Leider habe ich diesen noch nicht verstanden (jetzt schon, nachdem ich diesen Text geschrieben habe). Den Aufschrieb von Sr (also Stronzium) nach dem Borschen Atommodell habe ich soeben der Frage als Ergänzung angefügt. Kannst du mir das vielleicht vielleicht erklären, wie man bei Elementen höherer Periode vorgeht (höher als 4)? Bei Stronzium habe ich es so verstanden, dass aufgrund der Tatsache, dass die Nebengruppen von der 4. Zeile in die 3. Zeile gerutscht sind, in der 3. Zeile 18 e^- (8+10 von der vierten Zeile) und in der 4. Zeile 8e^- stehen (18-10, die in die 3. Zeile gerutscht sind). Und in der letzten und fünften Schale von Sr (also Stronzium) kommen 2 Elektronen, da Se (also Stronzium) die Hauptgruppe 2 hat.
Wie wäre es bei Elementen höherer Perioden? Rutschen die Hauptgruppen wieder?