Chemie Hilfe dringend?
Kann jemand mir bitte bei dieser Aufgabe helfen:
bei nr. 7
1 Antwort

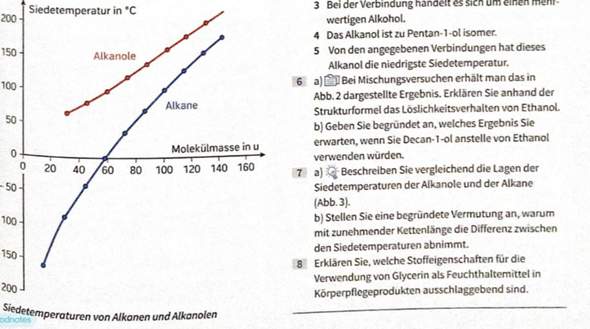
Dem Diagramm kann man ja zunächst entnehmen, dass die Siedetemperaturen der Alkanole grundsätzlich höher sind als die der Alkane. Das liegt daran, dass Alkanole eine funktionelle Gruppe, und zwar die Hydroxy-Gruppe (OH-Gruppe) besitzen.
Die Bindung ist hier polar und zwischen dem O-und dem H-Atom wirken Wasserstoffbrücken. Die Anziehungskräfte zwischen den Alkanolen sind somit stärker als zwischen den Alkanen, bei denen lediglich Van-der-Waals-Wechselwirkungen vorliegen.
Jedoch nimmt die Differenz der Siedetemperaturen mit zunehmender Kettenlänge ab. Dies ist dadurch bedingt, dass der polare Teil (OH-Gruppe) mit zunehmender Kettenlänge immer kleiner wird und der unpolare Teil (Van-der-Waals-Kräfte) somit überwiegt. Der polare Teil hat dadurch keinen großen Einfluss mehr auf die Siedetemperaturen der Alkanole.