Wie viel Mol Kohlenstoffwerden benötigt, um 215,4 gramm schwarzes Eisen(||)oxid? (FeO) vollständig zu reduzieren?
Bei der Frage brauche ich unbedingt Hilfe! Am Besten wäre die Lösung mit Beschreibung, damit ich es verstehe. Und wenn das möglich wäre, hätte ich das Ergebnis gerne in Gramm. Außerdem muss ich wissen, wie viel Gramm Eisen dabei gewonnen werden?
Danke schon mal im voraus!
3 Antworten

Schritt 1: Reaktionsgleichung aufstellen:
2 FeO + 1 C --> 2 Fe + 1 CO2
Schritt 2: Über die Formel (n = m/M) für eine der Substanzen die Stoffmenge ausrechnen.
Da hier die Masse(m) 215,4[g] FeO angegeben ist, muss man M für FeO aus dem PSE raussuchen (M = 71,85 [g/mol]) und dann geteilt rechnen:
n = 215,4[g] / 71,85[g/mol] = 3 [mol]
Schritt 3: Dreisatz aus Klasse 5 anwenden
Man kann eine Reaktionsgleichung erweitern. Wenn man das mit Faktor 2 macht, sähe das so aus: 4 FeO + 2 C --> 4 Fe + 2 CO2 (nur ein Beispiel). Nun muss man die Reaktionsgleichung aber so erweitern, dass vor dem FeO eine 3 steht. Denn das wurde in Schritt 2 ausgerechnet. Deswegen wird die komplette Reaktionsgleichung mit dem Faktor 1,5 erweitert:
3 FeO + 1,5 C --> 3 Fe + 1,5 CO2
Schritt 4: Rückrechnen auf eine Masse
Jetzt könnte man für jeden der 4 Stoffe mit der Formel (m = n • M) analog zu Schritt 2 wieder eine Masse ausrechnen.
Das ist hier aber gar nicht nötig, weil die Menge an Kohlenstoff laut Aufgabenstellung in mol angegeben werden soll. Das kann man am Ende von Schritt 3 einfach ablesen:
1,5 mol C (also Kohlenstoff)

Es ist doch nun recht simpel, hier die Reaktionsgleichung aufzustellen. Das FeO und der Kohlenstoff C sind die Edukte und Kohlendioxid CO2 und Eisen Fe sind die Produkte. Also erst mal ins Unreine:
FeO + C --> Fe + CO2 (1)
Das Eisenoxid wird dabei reduziert und der Kohlenstoff gleichzeitig oxidiert (Redox). Nun stimmt die Gleichung (1) noch nicht, weil die Bilanz (gleiche Stoffmengen rechts und links) nicht passt. Rechts ist ein O mehr als links. Das wird korrigiert, indem die Stoffmenge von FeO verdoppelt wird:
2 FeO + C --> Fe + CO2 (2)
Die Sauerstoffbilanz stimmt jetzt, aber nicht die des Eisens. Aus 2 FeO müssen natürlich auch 2 Fe werden. Also nächste Korrektur:
2 FeO + C --> 2 Fe + CO2 (3)
In Gl. (3) stimmt jetzt alles und die Reaktionsgleichung ist korrekt. Diese Gleichung gibt Dir an, in welchen Stoffmengenverhältnissen die Reaktanden zueinander stehen. Mit n = m/M bzw. m = n*M kannst Du das in die Massenverhältnisse umrechnen und damit m(C) und m(Fe) bestimmen.

Wie wäre, es, wenn Du die Reaktionsgleichung aufstellst und ermittelst wie viel mol 215,4 g Eisen(II)oxid entspricht.
Danach schaust Du Dir die Verhältnisse an, wieviel Mol Kohlenstoff für ein Mol des Oxides benötigt werden und setzt es in Relation auch zum Endprodukt
Hier mal die Tabelle
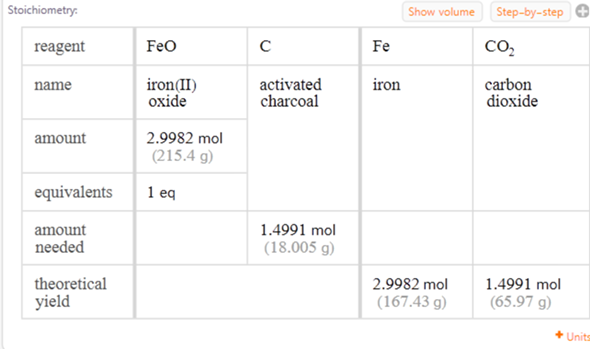
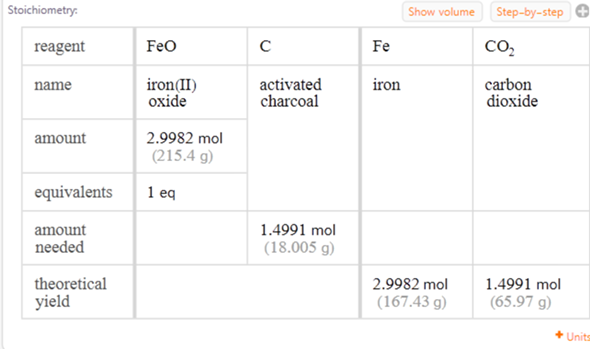

Zur Kontrolle: Du erhältst 167,43 g Eisen und etwa 18 g Kohlenstoff werden benötigt. - Viel Erfolg

Danke! Glaub jetzt schaffe ich es!

Ich schaffe es dich nicht! Ich brauche dafür die einzelnen Schritte zur Lösung?

Sorry, die gebe ich nicht :) das würde Dir nicht helfen. Eine Anleitung hast Du bestimmt in deinen Unterlagen

Es gibt keine Unterlagen, das soll ja die Beispiel Lösung für meine Unterlagen werden, aber dafür brauch ich jmd der/die das erklärt, so das ich es in meinen Worten erklären kann

Hab Dir mal ne Tabelle an meine ursprüngliche Antwort gepackt
Aber das kann ich ja nicht! Ich möchte es aber gerne verstehen, kenne aber keinen der mir das Erklären kann!