Warum schwimmt Eis auf kochendem Wasser?
Eis schwimmt auf kaltem Wasser, da das Eis eine geringere Dichte hat als kaltes Wasser (ca. unter 8°C).
Ab 8°C (8°C-100°C) wird die Dichte des Wasser jedoch kleiner als die des Eises (0°C) warum schwimmt das Eis trotzdem noch obwohl es eine größere Dichte hat?
5 Antworten
In Eis ist in aller Regel noch ne ganze Menge Luft eingesschlossen, die nicht mit zur Dichte zählt, diese aber effektiv verringert.
Eis hat zu jedem Zeitpunkt eine geringere Dichte als Wasser zwischen 0-100°C. Deine zweite Aussage (..ab 8°C...) ist also falsch
m.f.G.
anwesende
Das von dir gezeigte Bild sagt eindeutig, daß die Dichte von Eis zwischen -150 bis 0°C kontinuierlich unter der Dichte von Wasser zwischen 0 und 100°C liegt;
Was verstehst du an dem Bild nicht?
Wenn du lieber alles in Zahlen hast:
http://www.wissenschaft-technik-ethik.de/wasser_dichte.html#kap02
m.f.G.
anwesende
Da interpretierst Du das Diagramm nicht richtig
Die Dichte von Wasser ist immer höher als die von Eis
Eis maximal (bei -150°C) ca. 0,930g/cm³, Wasser minimal (bei 100°C) ca 0,960g/cm³
Diagramm folgt (separate Antwort)
Du irrst. Und hast die verlinkte Grafik irgendwie völlig falsch interpretiert.
Ab 8°C (8°C-100°C) wird die Dichte des Wasser jedoch kleiner als die des Eises (0°C)
Das ist schlichtweg falsch. Eis hat eine Dichte von 0,918 g/cm^3 und kochendes Wasser hat eine Dichte von 0,958 g/cm^3.
http://www.internetchemie.info/chemie-lexikon/daten/w/wasser-dichtetabelle.php
Warum steht das hier anders? Ist das auch falsch?
Wieso? Da steht, dass kochendes Wasser eine Dichte von 0,95907 g/cm^3 hat. Das entspricht meinen Angaben. Damit hat Eis mit 0,918 g/cm^3 immer noch eine geringere Dichte und schwimmt deswegen oben.
Glaube nicht, dass das woanders so steht. Da hast du vermutlich nur etwas falsch verstanden.
Korrekt ist, dass Wasser eine Dichteanomalie bei 4°C hat. Da hat es die höchste Dichte und wenn es kälter oder wärmer wird als 4°C, nimmt die Dichte jeweils ab. Die Dichte sinkt jedoch nie unter die Dichte von Eis.
Also ich habe auf drei Seiten geschaut und überall stand 0,958 g/ml.
Für kochendes Wasser...aber Eis hat mit 0,918 g/ml eine deutlich geringere Dichte und deshalb schwimmt es.
Ich schätze das hat mit den Kräften zu tun und mit der Masse.
Diagramm zu meinem Kommentar
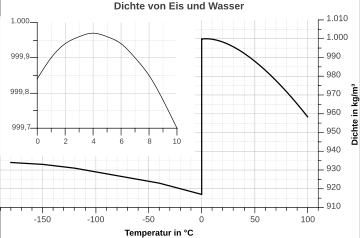
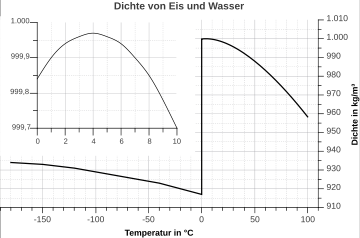
Ab 8°C nicht mehrhttps://goo.gl/images/82rQAn