Valenzstrichformel Chemie Kohlenstoffmonoxid?
Welche der beiden Valenzstrichformeln ist richtig?
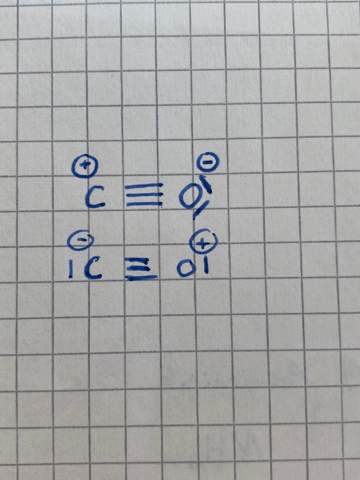
2 Antworten
Die obere ist schon deswegen falsch, weil der Sauerstoff ein Elektronendezett hat, mehr als ein Oktett ist aber nicht möglich. Das Sextett am Kohlenstoff ist auch ungünstig, die Elektronenlücke "will" gefüllt sein. Auch die Formel |C=O> ist, obwohl ohne Teilladung, instabil wegen des Sextetts beim Kohlenstoff.
Die untere ist auch nicht gerade optimal, weil der Sauerstoff entgegen seinen Neigungen eine positive Partialladung hat. Deswegen ist Kohlenmonoxid ja auch instabil und zerfällt - bei moderaten Temperaturen - zu Kohlenstoff und Kohlendioxid. Aber immerhin ist CO bei hohen Temperaturen stabil, weil genug Energie zur Erzeugung vorhanden ist, und bei niedrigen Temperaturen auch, weil der Zerfall sehr shr langsam erfolgt.
Elektronen haben zwei grundsätzliche Neigungen:
- Der elektrischen Anziehung zu folgen, also möglichst nah an den Kernen zu sein.
- Einen möglichst großen Raum einzunehmen, weil das gem. der Heisenbergschen Unschärfte die kinetische Energie vermindert.
Und dann müssen sie sich noch an Regeln halten, Orbitale, Quantenzahlen und so ...
Das untere ist die "offizielle" Strukturformel, im Übrigen isoelekronisch mit Stickstoff, Cyanid und Nitrosyl.
C wie O haben ein Oktett, je 3 bindende und 1 freies Elektronenpaar, 4*2=8.
Das negative Vorzeichen beim C kommmt ja nicht obendrauf, es ist das Resultat der Elektronenverteilung.
Tu ich nicht (und werd mal net frech ;o) ), für gewöhnlich ist es so, wie ich sagte. Wenn ich in der Organik meine Carbonylbindung habe und mir dort nach Protonierung alles anschaue, wird mit hoher Wahrscheinlichkeit die positive Ladung am C-Atom sein. Sauerstoff ist halt stärker EN
Wenn ich die 3 bindenden Elektronenpaare und das NB Elektronenpaar plus das Elektron addiere ;) hat sich aber alles erledigt
Die zweite. In der ersten fehlen dem Kohlenstoffatom zwei Elektronen, und das Sauerstoffatom überschreitet das Oktett.
Beim unteren Modell verwirrt mich aber, dass Sauerstoff ne positive Ladung hat ^^; sollte nicht so sein wegen EN
Doch, bei CO ist das so. Die Oktettregel hat in dem Fall höheres Gewicht. Das entspricht auch dem tatsächlichen Dipolmoment.
Dennoch seltsam, weil in der OC und der Logik nach Sauerstoff ja eigentlich eher elektronenziehend ist
Aus diesem Grund ist das Dipolmoment auch nur recht klein. Das sind zwei Effekte, die sich überlagern.
War der nicht irgendwo bei 0,1 ? Müsste das mal nachschauen
Das untere kann auch nicht existieren, schau Dir mal die Ladungsverhältnisse an (bzw. Anzahl der Bindungen an). Demnach hätte Kohlenstoff nun 9 Elektronen. Das geht nicht. Sauerstoff mit positiver Ladung ist zwar möglich, aber er wird seine Elektronen niemand dem Kohlenstoff geben, weiterhin passt das mit den Elektronen auch hier nicht.